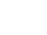Enfermedad celíaca
INTRODUCCIÓN
La enfermedad celíaca (EC) es una enteropatía inducida por el gluten de la alimentación que afecta a individuos genéticamente predispuestos y con unos factores ambientales propicios1,2. Todo ello determina la aparición de una lesión histológica característica, aunque no patognomónica, que en las formas más graves provoca atrofia de las vellosidades intestinales. Como consecuencia, puede producirse malabsorción de nutrientes (principios inmediatos, sales minerales y vitaminas) que conduce a diversos estados carenciales responsables de un amplio espectro de manifestaciones clínicas3.
La EC puede presentarse a cualquier edad de la vida, con una expresión clínica muy variada, aunque también puede ser asintomática. La demora diagnóstica es frecuente; se estima que, por cada paciente diagnosticado, existirían 5-10 pacientes sin diagnosticar4. De ahí la importancia del pediatra de Atención Primaria (PAP) en el diagnóstico precoz, que evitaría el desarrollo de complicaciones a largo plazo. La malignización es la complicación potencial más grave, probablemente determinada por la presencia mantenida del gluten en la alimentación.
Se ha considerado oportuno incluir algunas consideraciones sobre la EC y el paciente adulto, dada la estrecha relación que los PAP mantenemos no solo con los niños, sino también con sus familias.
DEFINICIÓN. ¿QUÉ ES LA ENFERMEDAD CELÍACA Y POR QUÉ SE PRODUCE?
La EC es una intolerancia permanente a las proteínas del gluten del trigo (gliadina), del centeno (secalina), de la cebada (hordeina) y del triticale (híbrido de trigo y centeno). La avena en estado puro (no contaminada por harina de trigo) no parece influir en la patogénesis de la enfermedad, pero no hay estudios concluyentes.
La etiología de la EC es desconocida; en su desarrollo contribuyen factores genéticos (sistema HLA II y otros genes fuera de la región HLA), ambientales (gluten) e inmunitarios1,5-8.
La ingestión de gluten conduce a la aparición de una lesión en la mucosa del intestino delgado superior, en un espectro que abarca desde un aumento de la población de linfocitos intraepiteliales (enteritis linfocítica) hasta atrofia vellositaria. Cualquiera de las formas histológicas de la enfermedad, incluso las más leves, pueden acompañarse de diversos estados carenciales y síntomas digestivos y extradigestivos. Todas estas manifestaciones, así como las alteraciones serológicas e histológicas, mejoran sensiblemente e incluso llegan a desaparecer al retirar el gluten de la dieta, reapareciendo al introducir de nuevo este elemento en la alimentación.
Además de la ingesta de gluten, factor ambiental imprescindible para el desarrollo de la EC, se han invocado como factores de riesgo el tipo de lactancia, la edad de introducción del gluten y su cuantía, la presencia de infecciones bacterianas o virales en el lactante o el aumento de la permeabilidad intestinal de personas susceptibles2,8. Algunos estudios sugieren que la duración mayor de la lactancia materna y la introducción de pequeñas cantidades de gluten antes de su retirada puede reducir el riesgo de EC, aunque todavía no se dispone de datos que demuestren que la protección es permanente o solo un retraso de la edad de presentación. El riesgo parece aumentar si se administra el gluten antes de los tres meses de edad, después de los siete meses o en grandes cantidades1,6,7,9. Por todo ello, el Comité de Nutrición de la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátrica (ESPGHAN) ha recomendado introducir el gluten entre los cuatro y los siete meses de edad, en pequeñas cantidades, de manera gradual, mientras el niño todavía está recibiendo pecho, y fomentar la lactancia materna prolongada, tratando de mantenerla un par de meses después de la introducción del gluten9.
MAGNITUD DEL PROBLEMA. EPIDEMIOLOGÍA
La EC es la enfermedad crónica intestinal más frecuente, afecta a niños y adultos y la relación mujer:varón es de 2:1.
Está presente en Europa y los países poblados por personas de ascendencia europea; también en Oriente Medio, Asia, Sudamérica y el norte de África, y puede llegar a afectar hasta al 1% de la población en algunos países occidentales10,11. Se considera que la epidemiología de la EC tiene las características de un iceberg, ya que un porcentaje importante de casos permanece sin diagnosticar4.
A pesar de que los estudios epidemiológicos realizados en otros países indican que la EC sin sintomatología clásica es más frecuente que la forma sintomática “típica”, en nuestro medio la EC se manifiesta preferentemente en su forma clásica y durante los primeros años de vida, por lo cual su detección constituye un reto para el sistema sanitario2,10,12.
El grupo de trabajo de EC de la Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica (SEGHNP) ha realizado un estudio multicéntrico nacional que encuentra una incidencia global estimada de8,21 casos nuevos de EC por cada1000 nacidos vivos, muy superior a la descrita en otros países europeos. Este trabajo es el primero realizado en nuestro país que obtiene datos de incidencia en población española10.
FORMAS CLÍNICAS DE LA ENFERMEDAD CELÍACA2,10,11
La EC clásica se caracteriza por la aparición de síntomas graves de malabsorción, estudio serológico positivo y atrofia grave de las vellosidades intestinales. Sin tratamiento, puede evolucionar a crisis celíaca, con hemorragias cutáneas o digestivas, edemas por hipoalbuminemia, deshidratación y malnutrición.
La EC no clásica (pauci- o monosintomática) puede cursar con síntomas intestinales y/o extraintestinales. El espectro histológico es variable, desde enteritis linfocítica hasta atrofia total, y el porcentaje de positividad del estudio serológico también (del 15 al 100%) dependiendo de la gravedad histológica.
La EC silente es asintomática, a pesar de presentar las lesiones histológicas características, incluso atrofia de vellosidades. Estos casos suelen detectarse por una determinación de marcadores séricos indicada en el seguimiento de los grupos de riesgo.
La EC latente se caracteriza por la existencia de una mucosa duodenoyeyunal normal en individuos que toman gluten en la dieta en el momento de ser evaluados, con o sin anticuerpos positivos, con o sin síntomas. Suelen tener familiares de primer grado con EC y deben ser controlados periódicamente.
PRESENTACIÓN CLÍNICA DE LA ENFERMEDAD CELÍACA A LO LARGO DE LA VIDA2-4,10-12
Las características clínicas de la EC varían según la edad de presentación.
En el niño pequeño, los síntomas intestinales y el retraso de crecimiento son frecuentes. Pueden presentar diarrea crónica, anorexia, estacionamiento ponderal, vómitos, dolor abdominal recurrente, laxitud e irritabilidad, apatía, introversión y tristeza. Los signos más frecuentes son la malnutrición, la distensión abdominal, la hipotrofia muscular, el estacionamiento pondoestatural, la anemia ferropénica y la hipoproteinemia.
La sintomatología digestiva puede estar ausente en el niño mayor y el adolescente con EC y cursar con anemia ferropénica, estreñimiento, dolor abdominal, menarquia retrasada o irregularidades menstruales, cefaleas, artralgias y hábito intestinal irregular. Los signos que presentan con mayor frecuencia son talla baja, aftas orales, hipoplasia del esmalte, distensión abdominal, debilidad muscular, artritis, osteopenia y queratosis folicular.
En el adulto, la EC también puede tener distintos patrones de presentación. Puede cursar con manifestaciones digestivas clásicas de un síndrome de malabsorción grave con esteatorrea y signos de malnutrición. En algunos adultos cuya enfermedad pasó desapercibida en la edad pediátrica, puede aparecer un cuadro de estas características a raíz de un acontecimiento vital estresante, una intervención quirúrgica o el embarazo.
Son más frecuentes las formas de presentación pauci- o monosintomáticas, y que los pacientes consulten por dispepsia, síndrome de intestino irritable, dolor abdominal y/o vómitos recurrentes de causa no aclarada. Otros síntomas extradigestivos relativamente frecuentes en el enfermo celíaco adulto son pérdida de peso, dolores óseos y articulares, historia de fracturas (ante traumatismos banales), parestesias, tetania, infertilidad, abortos recurrentes, irritabilidad, astenia, ansiedad, depresión, epilepsia y ataxia.
Otras situaciones que deben suscitar la sospecha a cualquier edad son la malnutrición, edemas periféricos, talla baja, neuropatía periférica, miopatía proximal, anemia ferropénica, hipoesplenismo, osteopenia u ostoporosis, aftas bucales recidivantes, descenso de la albúmina sérica, disminución del tiempo de protrombina, deficiencia de ácido fólico o vitamina B12 e hipertransaminemia. En la tabla 1 se muestran los síntomas y signos más frecuentes según la edad de presentación.
Tabla 1. Mostrar/ocultar
La dermatitis herpetiforme (DH) es la expresión cutánea de la EC en niños mayores, adolescentes y adultos jóvenes. Se manifiesta en forma de lesiones vesiculares pruriginosas en piel normal o sobre placas maculares localizadas simétricamente en cabeza, codos, rodillas y muslos.
El diagnóstico se realiza mediante la demostración por inmunofluorescencia directa de depósitos granulares de IgA en la unión dermoepidérmica de piel sana. Aunque los individuos con DH no presenten síntomas del tracto digestivo, habitualmente tienen el daño intestinal característico de la EC y mejoran con la retirada del gluten de la alimentación.
GRUPOS DE RIESGO Y ENFERMEDADES ASOCIADAS A LA ENFERMEDAD CELÍACA2,3,6
Son grupos de riesgo los familiares de primer grado de enfermos celíacos y los pacientes con enfermedades asociadas a la EC.
Los familiares de primer grado constituyen un grupo de riesgo elevado en el que la prevalencia de EC oscila entre el 5 y el 15% (15-30% si son DQ2 positivos). Aunque algunos de estos pacientes pueden permanecer asintomáticos o con expresión clínica poco relevante, cuando se lleva a cabo una búsqueda intencionada de síntomas y signos en esta población, puede detectarse astenia, flatulencia, ferropenia y osteoporosis, incluso en las formas histológicamente leves.
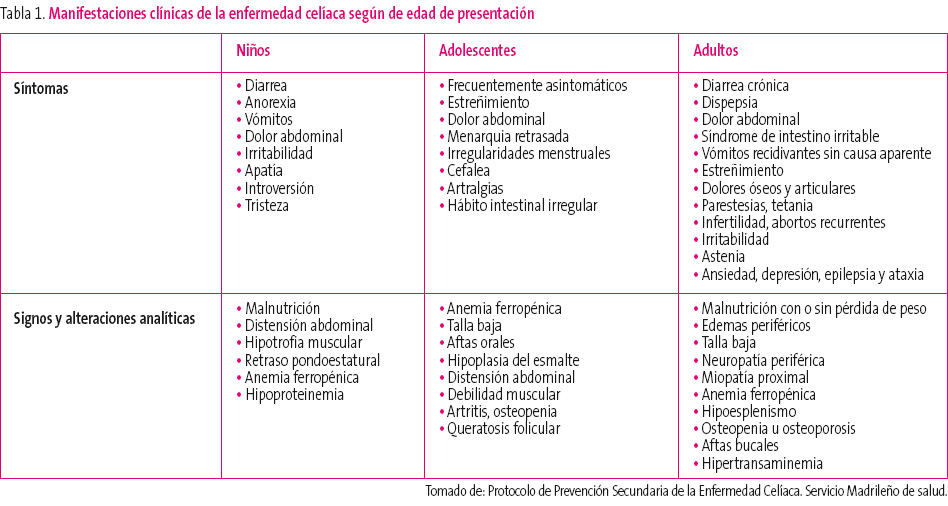
Las enfermedades asociadas suelen preceder a la EC, aunque también pueden manifestarse simultáneamente, e incluso después del diagnóstico. Los pacientes que las padecen son considerados grupo de riesgo, ya que su asociación se produce con una frecuencia superior a la esperada. Algunas enfermedades que pueden asociarse a la enfermedad celíaca se muestran en la tabla 2.
Tabla 2. Mostrar/ocultar
DIAGNÓSTICO
Sospecha clínica2,3,10,12
La EC es una entidad muy frecuente que en muchos casos permanece sin diagnosticar; de ahí la necesidad de llevar a cabo una búsqueda intencionada de síntomas o combinaciones de síntomas que deben suscitar la sospecha clínica. También se valorará que el paciente pertenezca a grupos de riesgo, ya sea por presentar alguna enfermedad que se pueda asociar con la EC o por tener familiares afectados. De momento, no existe suficiente evidencia para recomendar un cribado poblacional fuera de las situaciones anteriormente descritas.
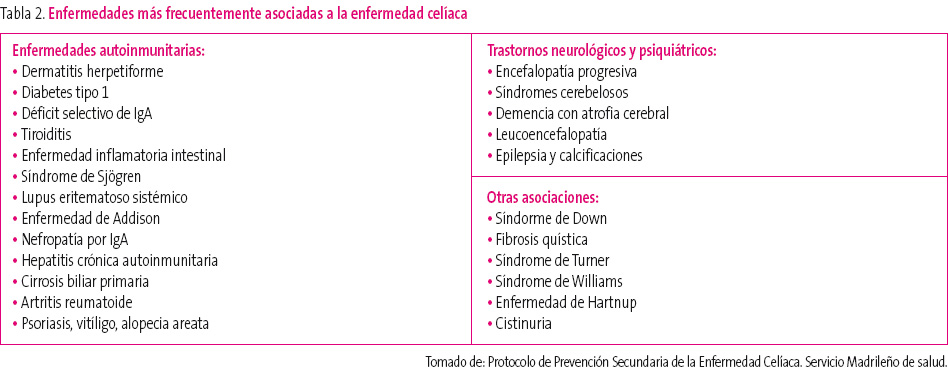
Algunas claves de interés para el diagnóstico precoz se muestran en la figura 1.
Figura 1. Mostrar/ocultar
Desde la consulta del PAP se puede solicitar un estudio analítico básico (hemograma y bioquímica) que evidencie la presencia de anemia o ferropenia o la elevación de las transaminasas. Son importantes la cuantificación de la inmunoglobulina A (IgA), porque los anticuerpos más eficaces y habitualmente utilizados en la detección de la EC determinan el isotipo IgA; el estudio de coagulación, si pensamos que el paciente va a necesitar una biopsia intestinal; y el estudio serológico de EC, que detecta los anticuerpos característicos que se producen en esta enfermedad. En 2008, el Ministerio de Sanidad y Consumo coordinó la realización de un documento de “Diagnóstico precoz de la enfermedad celíaca” por un grupo de expertos de diferentes sociedades científicas, con el objetivo principal de promover el diagnóstico precoz de la EC. Para facilitar el estudio desde atención primaria, se incluyó en las peticiones de analítica el llamado “perfil celíaco”, que incluía los parámetros anteriormente descritos.
También es conveniente realizar un estudio de parásitos en heces, ya que la infestación por Giardia Lamblia puede provocar sintomatología compatible con EC y falsos positivos en algunos test serológicos.
Los estudios de malabsorción como el test de la D-xilosa y la medida del contenido de grasa fecal no se realizan en el momento actual por su escasa especificidad.
Determinación de marcadores séricos2-4,13
La determinación de marcadores séricos ha sido decisiva para la detección de pacientes con sintomatología escasa que en el pasado hubieran quedado sin diagnóstico, y ha permitido el conocimiento del espectro clínico de la EC. Estos estudios inmunológicos miden los anticuerpos (Ac) frente a un antígeno alimentario (Ac antigliadina), y frente a antígenos tisulares como son los anticuerpos antidendomisio y antitransglutaminasa tisular.
La determinación de los Ac de la EC es importante para:
- Identificar a los pacientes que precisan una biopsia intestinal.
- Seleccionar pacientes con riesgo de desarrollar la EC (enfermedades asociadas y familiares de primer grado).
- Controlar la adherencia a la dieta exenta de gluten.
- Facilitar el diagnóstico diferencial.
-
Realizar estudios epidemiológicos de prevalencia de la enfermedad.
La negatividad de estos marcadores no excluye definitivamente el diagnóstico; en ocasiones, es necesario continuar el estudio y el seguimiento cuando la sospecha clínica es elevada.
Los siguientes marcadores serológicos han sido de gran utilidad para orientar el diagnóstico de EC, aunque de momento ninguno sirve todavía para el diagnóstico definitivo.
Los Ac antigliadina (AAG) fueron los primeros en utilizarse. Son Ac dirigidos contra las fracciones proteicas del trigo solubles en alcohol (gliadinas). Se realizan mediante análisis de inmunoabsorción ligada a las enzimas (ELISA), técnicamente fáciles, reproducibles y baratos. Son de clase IgA e IgG. Se utilizan preferentemente los de clase IgA, porque los de clase IgG son sensibles pero muy poco específicos, con un 30-50% de falsos positivos. Su positividad indica sensibilización al gluten, aunque no necesariamente lesión intestinal. La eficacia para el cribado de EC es mayor en niños menores de dos años, porque su producción cambia con la edad. Son poco sensibles en la detección de pacientes celíacos poco sintomáticos (familiares de primer grado de enfermos celíacos, pacientes con síndrome de Down) y pueden ser positivos en otras enfermedades (enfermedad de Crohn, intolerancias alimentarias, síndromes postenteritis). Actualmente, no se recomiendan para la detección de la EC en pacientes mayores de dos años porque su sensibilidad (probabilidad de que un paciente enfermo tenga un test positivo) y especificidad (probabilidad de que una persona sana tenga un test negativo) son bajas. Son útiles en el control de la adherencia a la dieta porque detectan satisfactoriamente las transgresiones ocasionales.
Una generación nueva de AAG son los Ac anti péptidos sintéticos deaminados de la gliadina (PDG), con sensibilidad y especificidad superior a los AAG.
Los Ac antiendomisio (AAE) son Ac de clase IgA frente a la proteína del endomisio que rodea las fibras musculares lisas. Su positividad se relaciona con la existencia de lesión en la mucosa intestinal, por lo que no detectan transgresiones ocasionales en la dieta y su desaparición tras la retirada del gluten es lenta. La sensibilidad y especificidad es superior al 90%, pero en muchos laboratorios se han dejado de realizar porque su determinación es laboriosa y su interpretación subjetiva.
Los Ac antitransglutaminasa tisular humana de clase IgA (AAtTG) son los marcadores serológicos más útiles para el cribado de EC, por lo que en el momento actual es el test serológico recomendado para el despistaje inicial de la EC. Los AAtTG IgA son los que muestran mejor capacidad diagnóstica, porque reflejan el estado de la mucosa intestinal. También está disponible la determinación de AAtTG de clase IgG, especialmente útil en caso de déficit de IgA asociado a EC. Son anticuerpos dirigidos contra la transglutaminasa tisular, principal antígeno, aunque no el único, de los AAE. Tiene muy buena correlación con los resultados de los AAE, pero es un método automatizado que no depende de la capacidad del observador y tiene mejor sensibilidad en los niños pequeños. Los AAtTG, una vez instaurada la alimentación exenta de gluten, no detectan las transgresiones ocasionales de la dieta.
La determinación de la IgA sérica total, simultáneamente a la de AAtTG, permite disminuir la proporción de falsos negativos, ya que los enfermos celíacos asocian un déficit selectivo de IgA con mayor frecuencia que la población general. En el caso de déficit de IgA, se solicitarán los anticuerpos de clase IgG.
Los test de lectura rápida se utilizan en estudios epidemiológicos por su sencillez, rapidez y escasa molestia para el paciente, aunque su precio es elevado. Son estudios inmunocromatográficos que utilizan sangre capilar y detectan anticuerpos antigliadina y AtTG. Especialmente útiles son los que determinan los isotipos IgA e IgG porque obvian el problema de los pacientes con déficit selectivo de IgA. Los resultados positivos precisan la confirmación con los métodos anteriormente descritos.
Algunos laboratorios están realizando técnicas de inmunoensayo múltiple, detectando combinaciones de marcadores serológicos como test de cribado inicial, ya que aumentan la sensibilidad de la prueba, aunque también los resultados falsos positivos.
El resultado de la serología determina la conducta a seguir, debiendo considerar las siguientes situaciones:
- Serología positiva. La sensibilidad de la serología es muy elevada (próxima al 100%), especialmente en personas con lesiones histológicas avanzadas (atrofia vellositaria). Por lo tanto, ante la presencia de síntomas sugestivos y serología positiva, debe derivarse al paciente a atención especializada para su valoración y la práctica de una biopsia intestinal si es precisa. En caso de alteraciones morfológicas compatibles, se procederá a retirar el gluten de la dieta.
- Serología negativa y elevada sospecha clínica. La serología negativa no permite excluir con seguridad el diagnóstico de EC en pacientes con lesiones histológicas poco avanzadas (Marsh 1 y 2). Por otro lado, el hecho de presentar alteraciones morfológicas poco relevantes (enteritis linfocítica sin atrofia vellositaria) no excluye que el enfermo presente síntomas y signos de enfermedad clínicamente relevante (astenia, flatulencia, anemia, osteopenia, etc.). Por este motivo, ante la presencia de síntomas sospechosos con serología negativa, sobre todo en grupos de riesgo, debe considerarse la posibilidad de derivar el caso para proseguir su evaluación en un medio especializado.
Estudio genético2,3,11,13
La EC tiene un carácter hereditario y muestra una fuerte asociación con la región HLA de clase II. El 90-95% de los pacientes celíacos son HLA-DQ2 o DQ8 positivos. Sin embargo, el valor del estudio genético en el diagnóstico de la EC está limitado porque el 25-30% de la población general presenta el heterodímero DQ2. Tiene valor predictivo negativo: sin predisposición genética es muy poco probable desarrollar la EC. Por ese motivo, el estudio genético permite excluir la EC con un 99% de certeza y es útil en las siguientes situaciones:
- Investigar la existencia de EC en pacientes con sospecha clínica bien fundada y estudio serológico negativo. Si el estudio genético es negativo, debería plantearse un diagnóstico alternativo. Un resultado positivo, aun en presencia de una serología negativa, obliga a considerar la necesidad de realizar una biopsia duodenal.
- Para seleccionar individuos susceptibles de desarrollar EC entre los pacientes con enfermedades asociadas con anticuerpos positivos y biopsia intestinal normal. Estos pacientes son DQ2 o DQ8 positivos deben ser tributarios de un seguimiento clínico y analítico, dado que pueden desarrollar la enfermedad en una etapa posterior.
- Excluir EC en pacientes con sintomatología compatible, serología negativa y biopsia normal.
- Investigar la susceptibilidad genética en familiares de un paciente celíaco.
- Pacientes con anticuerpos positivos que rechacen la biopsia.
- Pacientes que siguen una dieta sin gluten, sin haber realizado previamente una biopsia intestinal.
Biopsia intestinal2,3,11
La prueba de oro para establecer el diagnóstico definitivo consiste en la práctica de una biopsia duodenoyeyunal, que siempre debe realizarse antes de retirar el gluten de la dieta. Es imprescindible un estudio de coagulación previo, ya que algunos pacientes pueden tener un déficit de protrombina secundario a la malabsorción de vitamina K.
En la actualidad, la mayoría de las biopsias intestinales se realizan mediante endoscopia, que facilita la obtención de biopsias múltiples de duodeno y aumenta el rendimiento de la prueba, ya que las lesiones pueden ser parcheadas. El resultado del estudio anatomopatológico permite confirmar la existencia de lesiones compatibles con la EC y establecer el estadío de la lesión (Clasificación de Marsh). El espectro de lesiones histológicas que presentan estos pacientes es amplio y oscila desde formas de enteritis linfocíticas, donde únicamente se encuentra un incremento de la población de linfocitos intraepiteliales (> 25%, Marsh 1), hasta formas de atrofia grave de la mucosa (Marsh 3). Es importante disponer de inmunotinciones para llevar a cabo el contaje de linfocitos intraepiteliales, cuando las tinciones con hematoxilina-eosina no son concluyentes. Solo de este modo pueden diagnosticarse con seguridad las formas de enteritis linfocítica (> 25 linfocitos/100 células epiteliales).
Cualquiera de las formas histológicas mencionadas es compatible con la EC, pero ninguna de ellas es específica. De ahí la importancia del estudio serológico y del estudio genético (en caso de serología negativa y alta sospecha clínica), para reforzar el diagnóstico y la necesidad de verificar tanto la mejoría clínica como la resolución de las lesiones un tiempo después de haber retirado el gluten de la dieta. Con frecuencia, la recuperación es lenta, por lo que la biopsia de confirmación no debería realizarse antes de 18-24 meses.
Existen pacientes con serología positiva y biopsia intestinal normal; son casos de EC latente que requieren un seguimiento estricto hasta descartar o confirmar la EC de forma definitiva.
EVOLUCIÓN DE CRITERIOS DIAGNÓSTICOS2,3,11
Los criterios utilizados para el diagnóstico de la EC han variado en la última década del siglo xx. En el año 1969 la ESPGHAN estableció que el diagnóstico definitivo de EC precisaba de la realización de tres biopsias intestinales; la primera en el momento inicial del diagnóstico, demostrando atrofia vellositaria severa con dieta libre que incluyese gluten; una segunda con normalidad histológica de la mucosa intestinal después de someter al paciente a una dieta sin gluten (DSG); y una tercera biopsia para comprobar la recaída histológica después de reintroducir el gluten en la alimentación del paciente.
En 1989 se establecieron unos nuevos criterios que exigían:
- Una primera biopsia intestinal que demostrase la lesión vellositaria, absolutamente necesaria para el diagnóstico.
- La desaparición de los síntomas y signos clínicos.
-
La negativización de los marcadores serológicos tras la exclusión del gluten de la dieta.
La provocación con gluten quedaba reservada para los pacientes con diagnóstico dudoso de EC (biopsia intestinal inicial dudosa), personas que habían retirado el gluten de la dieta sin biopsia inicial, niños en los que el diagnóstico se realizó en los dos primeros años de vida y adolescentes que se autoprovocan ingiriendo gluten en su dieta.
En el año 2000, se revisaron los criterios diagnósticos de EC, señalando que el diagnóstico de EC debe ser confirmado más allá de toda duda pues el tratamiento requiere DSG de por vida. En el momento actual, una biopsia intestinal con hallazgos compatibles es imprescindible para su diagnóstico.
Es conveniente realizar además biopsias pre- y postprovocación en caso de dudas en el diagnóstico inicial, individualizando en los casos de primera biopsia patológica hecha a una edad menor de dos años y en caso de EC silente.
TRATAMIENTO
Dieta sin gluten2,3,11
Actualmente, el único tratamiento eficaz de la EC es la dieta estricta sin gluten durante toda la vida, realizando una alimentación sana y equilibrada ajustada a las necesidades de cada paciente. El gluten está presente en los alimentos que contienen harina de trigo, centeno, cebada y avena, constituyendo el 90% de las proteínas de estos cereales. No todas las fracciones del mismo son igualmente dañinas para los enfermos celíacos, siendo las prolaminas las que han demostrado su toxicidad. El nombre de las mismas es distinto en cada cereal: gliadina en el trigo, secalina en el centeno, hordeína en la cebada y avenina en la avena; así como el porcentaje en cada grano siendo cinco veces menor en la avena que en el resto. Por lo tanto, hay que excluir de la dieta el trigo, la cebada, el triticale, el centeno y todos sus derivados, incluidos los almidones. Probablemente, la avena no ejerce un efecto nocivo por sí misma; sin embargo, la alta posibilidad de contaminación con otros cereales, junto con el escaso seguimiento en el tiempo de los estudios realizados que no descartan la alteración histológica a largo plazo, hacen que por el momento se excluya de la dieta.
El consumo de productos manufacturados conlleva riesgos potenciales, por eso la dieta basada en alimentos naturales (carnes, pescados, huevos, leches y derivados, legumbres, frutas, verduras, hortalizas y cereales sin gluten como el maíz o el arroz) es preferible y más sencilla de llevar a la práctica. Como norma general, deben eliminarse de la alimentación los productos a granel, los elaborados artesanalmente o los que no estén etiquetados, donde no se pueda comprobar el listado de ingredientes.
El consumo de pequeñas cantidades de gluten puede causar trastornos clínicos, biológicos e histológicos. Existe, no obstante, una cuestión por resolver en cuanto a los niveles tóxicos para los pacientes celíacos y las diferentes sensibilidades individuales. Se ha demostrado que cantidades de 500 mg de gluten al día producen lesión intestinal, y aunque parece establecido actualmente que el límite de seguridad está entre 10 y 100 mg al día, se necesitan más estudios para fijar la cantidad inofensiva.
De manera que, actualmente, la DSG es el único tratamiento de la EC y debe seguirse durante toda la vida en pacientes tanto sintomáticos como asintomáticos.
Con la DSG, la mejoría de los síntomas se consigue a partir de las dos semanas, aproximadamente, la normalización serológica entre los seis y los 12 meses, y la recuperación de las vellosidades intestinales tras 1-2 años de iniciado el tratamiento.
Según la severidad de la malabsorción o del grado de malnutrición del paciente, puede ser necesario instaurar inicialmente un tratamiento dietético especial; así, en algunos lactantes o niños pequeños puede ser beneficiosa la retirada temporal de la lactosa.
PERSPECTIVAS TERAPÉUTICAS PARA LA EC5,14
Los avances en el conocimiento de las bases moleculares de la EC han impulsado estudios que pretenden desarrollar nuevas terapias que faciliten el seguimiento de la DSG. Se trata de evitar dificultades tales como la escasa palatabilidad, los cambios de hábitos alimentarios ya establecidos, el coste elevado de los alimentos sin gluten, los problemas con el etiquetado de los alimentos, etc. Se describen a continuación algunas líneas de investigación. Terapia enzimática: una posibilidad en estudio es la administración oral de la enzima prolyl peptidasa como suplemento dietético cada vez que el paciente vaya a ingerir alimentos con gluten. La prolyl peptidasa es capaz de fragmentar un péptido de 33 aminoácidos perteneciente a la gliadina que, junto con la glutenina, forman el gluten, disminuyendo su toxicidad.
Estrategias de inmunomodulación
Los estudios para identificar los péptidos del gluten capaces de unirse a las moléculas HLA-DQ2/DQ8 y ser presentados a linfocitos T CD4+ del intestino permitirán diseñar estrategias terapéuticas cuya finalidad es evitar el inicio o detener el curso de la respuesta inmunitaria anormal frente al gluten.
Modificación o detoxificación del gluten de la dieta: mediante la producción de cereales exentos de las fracciones tóxicas del gluten, utilizando métodos tradicionales (selección de semillas), o ingeniería genética (semillas transgénicas).
Por el momento, ninguna de estas estrategias está disponible en la práctica clínica, y deberán demostrar sus ventajas y seguridad respecto al tratamiento actual de la DSG. La falta de un modelo animal para probar la eficacia de estas estrategias, especialmente de la inmunomodulación, hace que el paso del laboratorio a la clínica sea mucho más lento y difícil.
SEGUIMIENTO
Sospecha diagnóstica y derivación a atención especializada
¿Cómo reacciona la familia de un niño celíaco ante el diagnóstico y lo que este conlleva? Hay familias que lo perciben como una tragedia: “¿Por qué me ha tenido que pasar esto a mí?”; familias que se culpabilizan mutuamente: “¿En tu familia ha habido más celíacos?”; familias que se desbordan y no saben qué hacer y, por último, familias responsables, que son capaces de afrontar, decidir y apoyar a sus hijos en los momentos importantes.
Es cierto que el diagnóstico puede significar un trauma para los padres pero, a la vez, hay que percibirlo como una liberación, ya que descarta otras patologías imaginadas por los progenitores y que originan angustia.
La edad del recién diagnosticado y la percepción que los padres tengan del diagnóstico determinará su capacidad para afrontar la situación. Para un lactante de 12 meses que todavía mantiene una dieta basada principalmente en papillas y purés, y que depende exclusivamente de sus cuidadores para alimentarse, el cambio a la dieta sin gluten no tiene por qué ser traumático. Para un niño mayor de 24 meses, más autónomo y con una dieta más amplia, es imprescindible un cambio de hábitos en su alimentación, que el niño ya percibe como tales. La educación variará en función del abanico de alimentos con gluten que consuma y las costumbres y actitudes alimentarias familiares. Para los padres de niños con escasa ganancia pondoestatural o que perciben como “enfermos” a sus hijos, el diagnóstico significa una liberación. Afortunadamente, cada vez es más conocida por la población la EC, su significado y su tratamiento. Aunque el diagnóstico sea una “mala noticia”, con frecuencia los padres conocen algún niño celíaco al que han tenido la oportunidad de ver y considerar “sano”. En esos casos, asumir la situación no tiene por qué afectar más allá del aprendizaje de una dieta y los pertinentes controles médicos.
Por tanto, es necesario recordar que cada circunstancia personal, familiar y social necesitará distintos enfoques. Es muy importante que el PAP explique claramente que, hasta que el niño sea evaluado a nivel especializado, debe continuar con su dieta habitual. La retirada precoz del gluten de la alimentación antes de la confirmación de la sospecha diagnóstica mediante biopsia solo contribuye a demorar y dificultar el diagnóstico de certeza, y, por lo tanto, repercute negativamente en la calidad de vida del niño2,3,12. Todos sabemos lo difícil que es, a veces, convencer a los padres de que esa espera es necesaria.
Por otro lado, debemos transmitir a los padres y al paciente que se trata de una sospecha, no de un diagnóstico confirmado.
Seguimiento a largo plazo2,13,15
Una vez confirmado el diagnóstico y establecida la DSG, es preciso realizar un seguimiento clínico-analítico de los pacientes con objeto de vigilar la evolución de los síntomas, controlar el crecimiento en los niños y asegurar el cumplimiento de la DSG.
Este seguimiento periódico debe prolongarse a lo largo de toda la vida, con el fin de detectar posibles complicaciones y enfermedades asociadas que pueden aparecer en cualquier momento de la evolución de la EC.
La frecuencia de los controles variará con la evolución del paciente. Al principio del tratamiento, si fuera necesario, se harán mensualmente, hasta la desaparición de los síntomas asociados, y posteriormente los pacientes con una respuesta satisfactoria pueden controlarse anualmente, para verificar el crecimiento, el cumplimiento de la DSG y realizar una exploración física y un control analítico rutinario. Hasta ahora, y en la mayoría de los casos, estos controles han sido realizados exclusivamente por los Servicios de Gastroenterología Pediátrica.
Para cumplir el objetivo de detectar posibles complicaciones y enfermedades asociadas, todos los pacientes celíacos, incluso aquellos en aparente normalidad, deben controlarse de por vida.
En cada visita hay que insistir, tanto al paciente como a sus familiares, en la necesidad de realizar estrictamente la DSG durante toda la vida. Es muy importante recomendar, desde el primer momento, el contacto y la pertenencia a la Asociación de Celíacos, de la que existe una en cada comunidad autónoma. El hecho de vincularse a un grupo de apoyo nacional y local es de gran valor para ayudar al paciente y su familia a manejar la enfermedad y la dieta. Las asociaciones aportan información acerca de la EC en todos sus aspectos prácticos, siendo especialmente útil la puesta al día que, periódicamente, ofrecen respecto al contenido en gluten de los múltiples alimentos manufacturados, así como de los preparados comerciales sin gluten.
Los objetivos fundamentales que cumplir en el seguimiento clínico-analítico periódico de los pacientes celíacos son dar información y apoyo continuado al paciente y sus familiares, valorar los síntomas asociados y del crecimiento, vigilar la adherencia a la DSG y detectar posibles enfermedades asociadas y complicaciones.
Información y apoyo continuado al paciente y sus familiares
Dado el carácter permanente y estricto de la DSG, es imprescindible contar con la colaboración de los propios pacientes, así como de sus familiares, ayudándoles a solventar una serie de problemas de orden práctico y psicológico que suelen surgir durante la evolución de una enfermedad crónica como es la EC.
Control de los síntomas asociados y valoración del crecimiento
La frecuencia de los controles clínico-analíticos del paciente variará con el momento evolutivo de la EC. Al principio, puede ser necesario hacerlos con una mayor periodicidad hasta constatar la mejoría clínica y la desaparición de la sintomatología asociada.
Dependiendo del grado del daño intestinal antes del diagnóstico y de la edad del paciente, la mejoría de los síntomas puede tardar más o menos una vez que comienza el tratamiento.
En la infancia, la respuesta terapéutica es, en general, inmediata, estableciéndose un retroceso fácilmente apreciable de la sintomatología clínica. Sin embargo, en los niños más mayores y en los adultos, la mejoría puede ser más lenta y la evolución más complicada. El psiquismo y el apetito experimentan una notable mejoría ya en las dos primeras semanas de iniciado el tratamiento; posteriormente, se normaliza el tránsito intestinal y la distensión abdominal, y la curva de peso se va recuperando. De modo paralelo, todas las alteraciones funcionales se van corrigiendo.
Deben realizarse los estudios analíticos habituales para identificar deficiencias nutricionales, entre los que se incluyen la hemoglobina, la vitamina B12, el ácido fólico, el hierro, la albúmina sérica y el calcio. Estas deben medirse fundamentalmente en el momento del diagnóstico, en las primeras revisiones postratamiento, durante las recaídas sintomáticas y de forma sistemática en el seguimiento anual. En los pacientes que fracasan en la respuesta a la DSG o recidivan, debemos, en primer lugar, asegurar que la DSG se cumpla bien, confirmar el diagnóstico y excluir otras enfermedades coincidentes.
Vigilancia del correcto cumplimiento dietético
En el seguimiento de los pacientes celíacos, la determinación periódica de los marcadores serológicos de la enfermedad es fundamental para valorar la adherencia a la DSG.
La respuesta de los distintos marcadores serológicos tras la dieta es variable. Los AAG IgA se normalizan aproximadamente entre los dos y los seis meses de la DSG, siendo más precoces que el descenso de los AAG de clase IgG, aunque se cumpla estrictamente la dieta, que tardan en normalizarse de 6-12 meses.
Los AAE descienden más lentamente que los AAG IgA, probablemente en relación con la recuperación de la lesión de la mucosa intestinal. La dinámica de los AATGt IgA es similar a la de los AAE; los valores se mantienen positivos incluso hasta 18 meses después de iniciado el tratamiento dietético, aunque en la mayoría de los casos se aprecia una tendencia a la negativización a partir de los seis meses de DSG.
Si no hay un cumplimiento riguroso de la dieta, los AATGt se mantienen elevados, probablemente como marcadores de una respuesta inflamatoria intestinal mantenida. Sin embargo, tras su negativización la realización de pequeñas transgresiones, voluntarias o involuntarias, o de carácter ocasional, no se manifiesta por un incremento significativo de ellos. Los AAE tampoco permiten detectar las pequeñas transgresiones dietéticas, incluso reiteradas.
El seguimiento mediante la determinación de AAG IgA permite, no obstante, confirmar tanto un incumplimiento habitual de la DSG como pequeñas transgresiones voluntarias o incluso alertar sobre la realización de trasgresión involuntaria (trazas de gluten). En aquellos pacientes que continúan con síntomas o presentan recidivas de los mismos, a pesar del régimen sin gluten, es obligado llevar a cabo una búsqueda intencionada de fuentes insospechadas de gluten en la dieta o de transgresiones mínimas. Ambas situaciones explican la mayoría de los casos que persisten sintomáticos o mantienen títulos elevados de marcadores séricos.
Detección de posibles complicaciones y enfermedades asociadas
El incumplimiento de la DSG aumenta el riesgo en estos pacientes de desarrollar complicaciones por afectación de cualquier órgano o sistema corporal, pudiendo aparecer a medio y largo plazo retraso de talla, osteopenia/osteoporosis, retraso del desarrollo puberal, anemia, hipoesplenismo, insuficiencia pancreática exocrina, crisis celíaca, yeyunoileítis ulcerativa crónica y sobrecrecimiento bacteriano. También aumenta el riesgo de enfermedades neoplásicas del tracto digestivo: carcinomas faríngeos y esofágicos, adenocarcinomas de intestino delgado y linfomas no Hodgkin. Se ha descrito igualmente una mayor prevalencia de otros tumores, tales como cáncer de faringe, esófago, estómago y recto.
Y por otra parte, a la EC se asocian otras enfermedades, como por ejemplo enfermedades autoinmunitarias, que habrá que tener en cuenta en el seguimiento clínico-analítico de los celíacos.
ALGUNAS CONSIDERACIONES FINALES
La EC es un modelo de enfermedad inmunitaria compleja, que resulta de la interacción de un modelo genético poligénico y factores ambientales. La carga genética es responsable de gran parte del fenotipo de la enfermedad: los estudios en gemelos sugieren que más del 80% del fenotipo depende de factores genéticos. Aunque la asociación con los haplotipos HLA DQ2 y DQ8 es muy importante, solo explicaría el 50% de la variabilidad genética de la EC.
Queda mucho por conocer, pero parece claro que, como pediatras de Atención Primaria, en nuestra mano está el fomento de la lactancia materna prolongada y, si es posible, introducir el gluten en pequeñas cantidades y de manera progresiva mientras el niño recibe pecho, entre los cuatro y los siete meses de edad. ¿El clásico currusco de pan de las abuelas?
La EC es una entidad prevalente en nuestro entorno, la importancia de su diagnóstico precoz reside en que la instauración de una DSG consigue, no solo la normalización del estado de salud, sino también la recuperación de la calidad de vida de los pacientes. El riesgo de enfermedades neoplásicas y, posiblemente, también de enfermedades autoinmunitarias, se iguala al de la población general a los diez años de la DSG. Por todo ello, es muy importante que los pediatras conozcamos bien cuándo hay que pensar en ella, cómo diagnosticarla y cómo facilitar al paciente ya diagnosticado y a sus padres la adherencia a la DSG de por vida. Actualmente, no está claro el beneficio que supone poner de manifiesto las formas latentes y silentes de EC, como tampoco la evolución, la adherencia a la DSG, ni los efectos adversos de la dieta en las formas asintomáticas de EC.
Las actuaciones dirigidas a mejorar el etiquetado de los productos alimentarios facilitan la identificación de los alimentos sin gluten (Reglamento CE N.º 41/2009 de la Comisión de 20 de enero de 2009 sobre la composición y etiquetado de productos alimenticios apropiados para personas con intolerancia al gluten). Asimismo, el avance en los métodos analíticos de detección de gluten; la formación de los manipuladores de alimentos y hosteleros sobre la naturaleza de la enfermedad y las características de la dieta sin gluten; la disponibilidad de menús sin gluten en comedores escolares, universitarios, de empresas, de los centros de tercera edad y hospitales favorecen el seguimiento de la DSG.

BIBLIOGRAFÍA
- Silano M, Agostoni C, Guandalini S. Effect of the timing of gluten introduction on the development of celiac disease. World J Gastroenterol. 2010;16(16):1939-42.
- Polanco Allué I, Ribes Koninckx C. Enfermedad celíaca. En: AEP, SEGHNP (ed.). Protocolos de Gastroenterología, Hepatología y Nutrición. Madrid: Ergón SA; 2010. p. 36-46.
- Hill ID, Dirks MH, Liptak GS, Colletti, RB, Fasano A, Guandalini S et al. Celiac Disease Guidelines Committee of the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. Guideline for the diagnosis and treatment of celiac disease in children: recommendations of the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Ggastroenterol Nutr. 2005;40:1-19.
- Cilleruelo Pascual ML, Román Riechmann E, Jiménez Jiménez J, Rivero Martín MJ, Barrio Torres J, Castaño Pascual A et al. Enfermedad celíaca silente: explorando el iceberg en población escolar. An Esp Pediatr (Barc). 2002;57:321-6.
- Schuppan D, Junker Y, Barisani D. Celiac disease: from patogénesis to novel therapies. Gastroenterology. 2009;137:1912-33.
- Norris JM, Barriga K, Hoffenberg EJ, Taki I, Dongmei Miao BS, Haas JE et al. Risk of Celiac Disease Autoimmunity and Timing of Gluten Introduction in the Diet of Infants at Increased Risk of Disease. JAMA. 2005; 293(19):2343-51.
- Farrell RJ. Infant gluten and Celiac Disease: too early, too late, too much, too many questions. JAMA. 2005;293(19):2410-12.
- Welander A, Röckert Tjernberg A, Montgomery SM, Ludvigsson J. Infectious Disease and Risk of Later Celiac Disease in Childhood. Pediatrics. 2010;125:530-6.
- Agostoni C, Decsi T, Fewtrell M, Goulet O, Kolacek S, Koletzko B et al. Complementary feeding: a commentary by the ESPGHAN Committéee on Nutrition. ESPGHAN Committee on Nutrition. Medical Position Paper. J Pediatr Gastroenterol Nutr. 2008;46:99-110.
- Grupo de trabajo de enfermedad celíaca de la SEGHNP. Registro español de enfermedad celíaca (REPAC). Estudios casos control de factores ambientales. Disponible en http://www.gastroinf.com/Estudio%20casos%20control%20mayo%202010.pdf
- Green PH, Cellier C. Celiac disease. N Engl J Med. 2007;357(17): 1731-43.
- Catassi C, Kryszak D, Louis-Jacques O, Duerksen DR, Hill I, Crowe SE et al. Detection of Celiac disease in primary care: a multicenter case-finding study in North America. Am J Gastroenterol. 2007;102:1454-60.
- Vargas MI, Melero J, Fernández de Mera JJ, González C, Catalina I, Romero A. Marcadores serológicos y genéticos en el diagnóstico y seguimiento de la enfermedad celíaca. An Pediatr (Barc). 2005;62(5): 412-9.
- Cornell H, Macrae F, Melny J, Pizzey C, Cook F, Mason S et al. Enzyme therapy for management of coeliac disease. Scand J Gastroenterol. 2005;40(11):1304-12.
- Pietzak MM. Follow-up of patients with celiac disease: achieving compliance with treatment. Gastroenterology. 2005;128:135-41.
LECTURAS RECOMENDADAS
- Polanco I, Roldán B, Arranz M. Protocolo de prevención secundaria en enfermedad celíaca. Dirección General de Salud Pública y Alimentación. Consejería de Sanidad y Consumo. Comunidad de Madrid. Mayo 2006.
- Galbe J, Grupo PrevInfad/PAPPS Infancia y Adolescencia. Cribado de enfermedad celíaca. Informe 2007. Disponible en http://www.aepap.org/previnfad/pdfs/previnfad_celiaca_rec.pdf
- Grupo de trabajo sobre “Diagnóstico precoz de la enfermedad celíaca”. Diagnóstico precoz de la enfermedad celíaca. Ministerio de Sanidad y Consumo. Madrid, 2008.
- Polanco Allué I, Ribes Koninckx C. Enfermedad celíaca. Protocolos de Gastroenterología, Hepatología y Nutrición. (AEP, SEGHNP) 2010. Madrid: Ergón S.A.; 2010. p. 36-46.
- World Gastroenterology Organisation Practice Guidelines: Enfermedad celíaca. guidelines@worldgastroenterology.org
- FACE. Federación de Asociaciones de Celíacos de España. http://www.celiacos.org/
-
Legislación de interés:
- http://www.celiacosmadrid.org/Reglamento_europeo.pdf
- http://www.celiacosmadrid.org/norma_codex_2008.pdf
- http://www.celiacosmadrid.org/nota_informativa_sobre_menus_sin_gluten.pdf
- http://www.celiacosmadrid.org/punto_colegio_2009-2010.pdf
- http://www.celiacosmadrid.org/dieta_sin_gluten_medicamentos_2.html