Nuevas recomendaciones del calendario de vacunaciones de la Asociación Española de Pediatría 2012 (2.ª parte). Revisión de los aspectos específicos de cada vacuna. Calendarios acelerados de vacunación para niños y adolescentes con vacunación incompleta
2 C. S. El Greco. Getafe. Madrid (España).
ASPECTOS ESPECÍFICOS DE CADA VACUNA
Vacunación frente a la hepatitis B
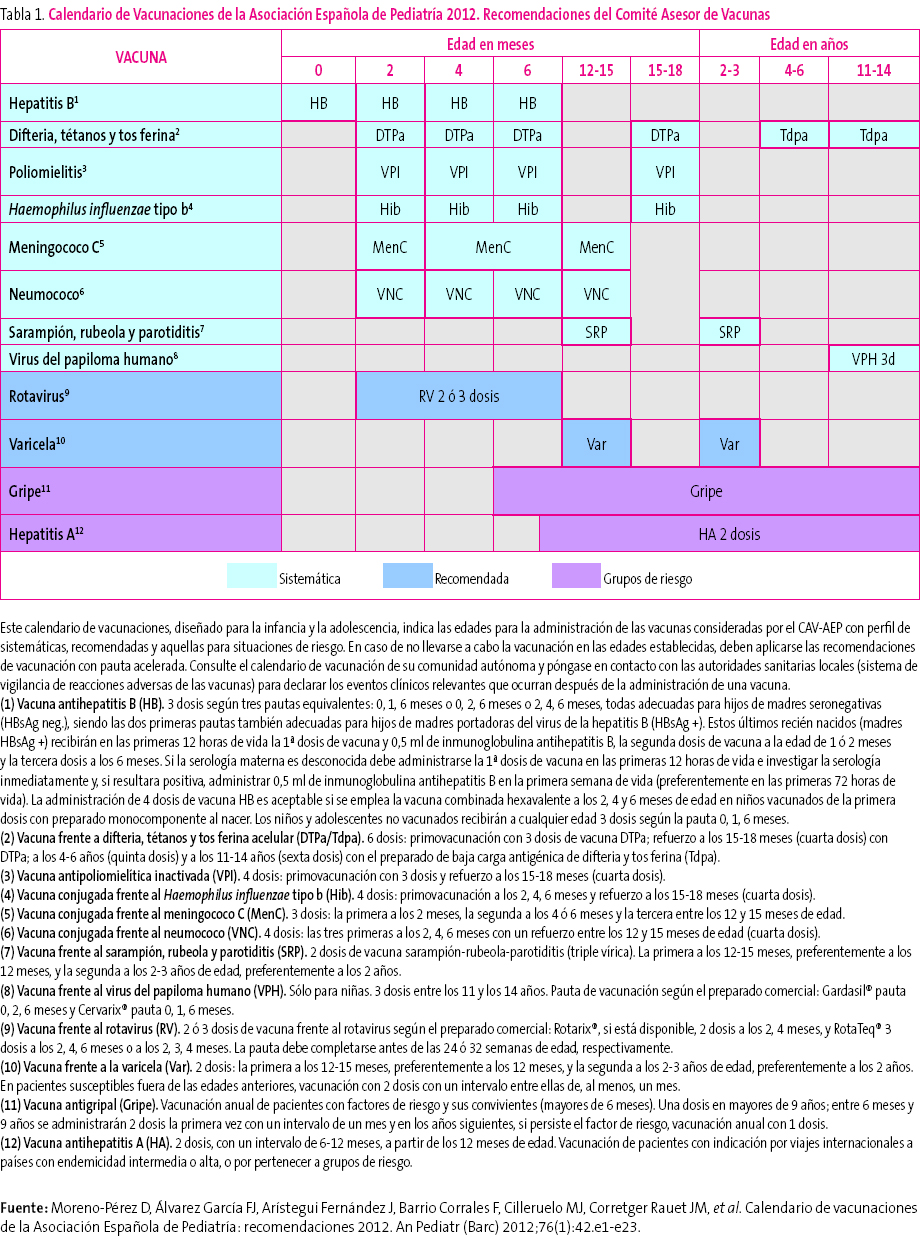
La vacunación frente a la hepatitis B requiere tres dosis que pueden administrarse según pautas equivalentes: 0, 1 y 6 meses; 0, 2 y 6 meses; 2, 4 y 6 meses. Los tres esquemas son adecuados para hijos de madres seronegativas (HBsAg [del inglés Hepatitis B surface Antigen] negativo), siendo las dos primeras pautas también correctas para hijos de madres portadoras del virus de la hepatitis B (HBsAg positivo). Estos últimos deben recibir, además, 0,5 ml de inmunoglobulina específica antihepatitis B, preferiblemente en las primeras 12 horas de vida, en un lugar anatómico diferente del de la vacuna. La vacunación en el primer año con cuatro dosis de vacuna es aceptable, si se utiliza la vacuna combinada hexavalente (DTPa-VPI-Hib-HB) a los 2, 4 y 6 meses de vida, para aquellas Comunidades Autónomas (CC. AA.) donde se vacuna frente a la hepatitis B al nacimiento con preparado monocomponente1-6. Otra opción, en caso de vacunación sistemática neonatal, es la administración alternante de vacuna hexavalente a los 2 y 6 meses, y pentavalente (DTPa-VPI-Hib) a los 4 meses3,4,6. La vacunación de rescate frente a la hepatitis B en niños mayores y adolescentes no vacunados con anterioridad se realizará siguiendo la pauta 0, 1 y 6 meses.
Vacunación frente a la difteria, el tétanos, la tos ferina (DTPa/Tdpa), la poliomielitis (VPI) y el Haemophilus influenzae tipo b (Hib)
El Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP) continúa recomendando el uso de la vacuna hexavalente (DTPa-VPI-Hib-HB) durante la primovacunación a los 2, 4 y 6 meses y la pentavalente como dosis de refuerzo a los 15-18 meses (cuarta dosis de DTPa-VPI-Hib). Por cuestiones económicas o por problemas de abastecimiento de vacuna hexavalente se puede recurrir al preparado pentavalente (DTPa-VPI-Hib), completándose el calendario sistemático con una o varias dosis frente a hepatitis B (monocomponente), según el esquema recomendado para esta vacunación3,4,6.
Vacunación frente a la difteria, el tétanos y la tos ferina
En España, la administración de la quinta dosis de DTPa correspondiente a los 4-6 años se ha venido realizando con DTPa (Infanrix®). Sin embargo, desde el año 2010, la tendencia es a sustituirla por la vacuna Tdpa (con baja carga antigénica de difteria y tos ferina) y así se ha realizado ya en 13 CC. AA. y en las dos ciudades autónomas4. El CAV-AEP comparte esta recomendación, pero además considera que la quinta dosis con la vacuna Tdpa debería ser complementada forzosamente con una sexta dosis de esta misma vacuna en la adolescencia6,7, estrategia que actualmente realizan la Comunidad de Madrid y las ciudades autónomas de Ceuta y Melilla5, dada la disminución de la inmunidad frente a la tos ferina que se produce con el paso de los años. El CAV-AEP estima que la edad óptima para esta dosis es de los 11 a los 14 años. En España, las recomendaciones oficiales del Ministerio consideran que los niños que completan su calendario de vacunación a los 14-16 años no precisarán otra dosis hasta los 60-65 años de edad y que un adulto está bien vacunado con cinco dosis de tétanos recibidas a lo largo de su vida8.
El CAV-AEP considera muy recomendable la vacunación frente a la tos ferina con Tdpa de los adultos y adolescentes que convivan con recién nacidos, para crearle un ambiente inmune, siguiendo la pauta conocida como “estrategia del nido”, que ha ofrecido buenos resultados9 e incluso está comenzando a practicarse en algunos países de forma rutinaria10.
Vacuna frente al Haemophilus influenzae tipo b (Hib)
La pauta de vacunación sistemática frente a Hib recomendada por el CAV-AEP no ha cambiado sustancialmente en relación a los años anteriores, comenzando su administración a partir de las seis semanas de vida. Se recomiendan tres dosis en el primer año de vida, con intervalos de 4-8 semanas entre ellas (2, 4 y 6 meses de edad) con las vacunas pentavalentes o hexavalente; en las vacunas Hib monocomponente, para niños entre 6 y 12 meses, son suficientes dos dosis con el mismo intervalo de tiempo. A los 15-18 meses de edad es obligada la dosis de refuerzo, quedando el sujeto inmunizado con niveles de eficacia próximos al 100%. En los niños de entre 12 y 14 meses no inmunizados previamente se recomiendan dos dosis y a partir de los 15 meses una única dosis, no siendo necesaria la vacunación en mayores de 59 meses inmunocompetentes3,4,6. Por encima de esta edad, la indicación de una dosis de vacuna se llevaría a cabo en individuos sin antecedentes de vacunación y con factores de riesgo de infección invasora por Hib: anemia de células falciformes, leucemia, inmunodeficiencias adquiridas, trasplante de médula ósea y asplenia anatómica o funcional6.
Vacuna antipoliomielítica inactivada
La vacuna antipoliomielítica inactivada (VPI) se encuentra formando parte de las vacunas pentavalentes y hexavalente. La pauta de administración en la primovacunación durante la primera infancia es de tres dosis de VPI en los meses 2, 4 y 6 y una cuarta de refuerzo a los 15-18 meses de edad3,4 que debe administrarse con un intervalo mínimo de seis meses respecto a la dosis previa6.
Vacunación frente al meningococo C
Respecto a las vacunas conjugadas monocomponente frente al meningococo C, el CAV-AEP recomienda realizar la primovacunación con dos dosis en el primer año (a los 2 y a los 4-6 meses de edad) y una dosis de refuerzo en el segundo año de vida, preferentemente entre los 12 y los 15 meses3,4.
El comité considera que muchos niños que recibieron la pauta de vacunación sin dosis de refuerzo en el segundo año de vida y que cumplen ahora 11 años de edad pueden ser susceptibles a las infecciones por meningococo C11, por lo que estaría recomendada una dosis de refuerzo adicional si las condiciones epidemiológicas así lo justificaran.
Vacunación frente al sarampión, la rubeola y la parotiditis (vacuna triple vírica)
El CAV-AEP mantiene la recomendación universal de vacunación con dos dosis de la vacuna triple vírica (TV) una vez cumplidos los 12 meses de edad, separadas por un intervalo mínimo de, al menos, cuatro semanas3,4,6. La primera dosis debería administrarse a los 12 meses de vida, aunque su aplicación entre los 12 y los 15 meses se considera como una alternativa aceptable. En ocho CC. AA. y en las dos ciudades autónomas ya se adoptó esta pauta, la mayor parte durante el año 2010, considerando que esta dosis es válida, en sustitución de la de los 15 meses5. El comité considera que la segunda dosis de la vacuna TV debería administrarse entre los 2 y los 3 años, preferentemente a los dos años.
Las medidas que se recomiendan en caso de alerta epidemiológica por brote de sarampión, son las siguientes12,13:
- En niños menores de seis meses se administrarán 0,25 ml/kg de inmunoglobulina polivalente, en dosis única, en los primeros seis días postexposición. No está indicada la administración de la vacuna TV.
- A los niños de entre 6 y 12 meses se les administrará una dosis de la vacuna TV (dosis no computable) y se les volverá a vacunar a los 12-15 meses con, al menos, un mes de intervalo, considerándose esta última como la primera dosis. Si hubiesen transcurrido más de 72 horas y menos de dos semanas desde la posible exposición, a los menores de 12 meses se les inyectará inmunoglobulina polivalente IM en vez de la vacuna. Posteriormente, 5 o 6 meses más tarde, deben recibir la vacuna TV.
- Se consideran personas susceptibles a aquellas menores de 40 años sin evidencia de haber padecido la enfermedad y que no acrediten antecedente de vacunación correcta con la vacuna TV según la edad. Se asume que las personas mayores de 40 años, al haber padecido la enfermedad, presentan una susceptibilidad muy baja por ser inmunes frente al sarampión.
- Aquellas personas no vacunadas menores de 40 años que hayan tenido contacto con los casos desde cuatro días antes a cuatro días después del inicio del exantema se les administrará una dosis de la vacuna TV en las primeras 72 horas tras la exposición.
- En los niños mayores de tres años se revisará su situación vacunal y se actualizará en caso necesario.
- A los niños inmunodeprimidos que hayan tenido contacto con sarampión se les administrará gammaglobulina intramuscular polivalente a la dosis de 0,5 ml/kg (dosis máxima 15 ml).
Vacunación frente al virus del papiloma humano
El CAV-AEP se adhiere a las recomendaciones del Consejo Interterritorial del Sistema Nacional de Salud en referencia a la vacunación sistemática frente al virus del papiloma humano (VPH) de todas las niñas de 11 a 14 años, como forma de prevenir el cáncer cervical y de lesiones precancerosas del tracto genital en la mujer2. Además, el comité recomienda la vacunación de todas las adolescentes que no hubiesen recibido la vacuna por superar la edad fijada por cada comunidad autónoma para la vacunación sistemática.
Durante el año 2011 se han producido cambios en las fichas técnicas de estas vacunas. Se ha autorizado recientemente en Europa el uso de la vacuna tetravalente (Gardasil®) en varones de 9 a 26 años para la prevención de las verrugas genitales externas14. Los primeros análisis demuestran que la vacunación de los varones podría ser coste-efectiva en situaciones de baja cobertura vacunal en niñas adolescentes, pero podría tener una relación coste-efectividad aún más favorable la estrategia basada en incrementar la cobertura de estas15.
Se ha incluido en la ficha técnica de la vacuna bivalente (Cervarix®) la indicación contra determinados serotipos no incluidos en la vacuna, como son los serotipos 31, 33 y 4516, a partir de los datos de eficacia protectora cruzada frente a la neoplasia intraepitelial cervical (CIN), procedentes del estudio PATRICIA, tras un seguimiento de cuatro años17.
La posología de las vacunas frente a VPH es de tres dosis (tabla 1) a los 0, 2 y 6 meses con la tetravalente14 y a los 0, 1 y 6 meses con la bivalente17, para garantizar la máxima eficacia vacunal esperable.
Tabla 1. Mostrar/ocultar
Vacunación frente al neumococo
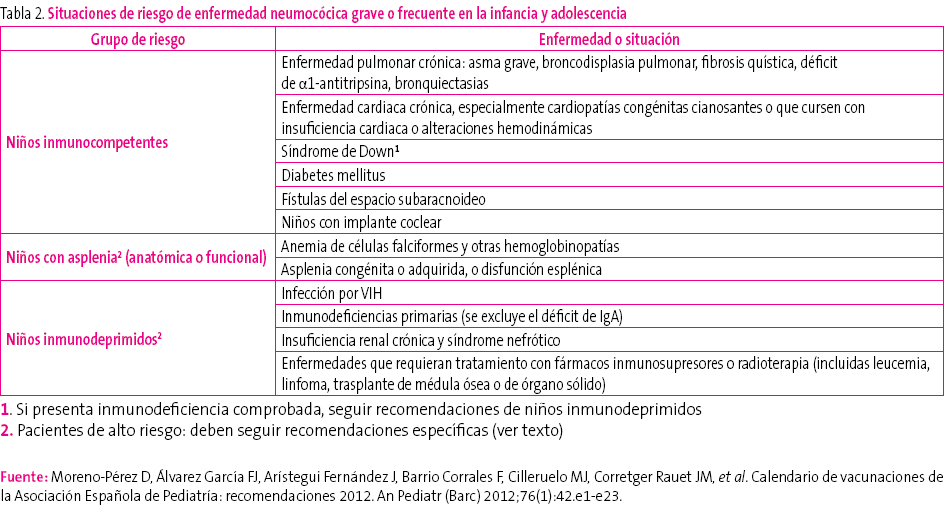
Como en años anteriores, el CAV-AEP mantiene la recomendación de la vacunación sistemática frente al neumococo como la mejor medida para la prevención de la enfermedad neumocócica en la infancia.
El cambio epidemiológico más llamativo en los últimos años ha sido el incremento del serotipo 19A18-22, un serotipo al que, en la actualidad, van ligadas, de forma mayoritaria, las multirresistencias (resistencias a tres o más familias de antibióticos), siendo responsable de casi todas las resistencias de alto nivel a cefalosporinas de tercera generación en las meningitis neumocócicas21,22.
Todavía hay pocos datos sobre la efectividad de las vacunas neumocócicas conjugadas de 10 serotipos (VNC10) y de 13 (VCN13), dado el corto periodo de tiempo transcurrido desde el inicio del uso de estas vacunas. El seguimiento de casi 3000 niños vacunados con la VNC13 en una región de Alaska ha mostrado, un año después de la vacunación, una efectividad del 85% en la reducción de la enfermedad neumocócica invasora (ENI) por cualquier serotipo, no habiéndose registrado ningún caso producido por los serotipos contenidos en la vacuna23. En el Reino Unido, la eficacia de la VNC13 frente a los serotipos adicionales (1, 3, 5, 6A, 7F y 19A) ha sido mayor del 50% en niños menores de dos años, al cabo de un año de iniciar la vacunación24. En EE. UU. también se ha constatado una disminución de más del 50% en los casos de la ENI por cualquier serotipo y del 70% en los casos producidos por los serotipos de la VNC13, comparando los periodos anterior y posterior a la introducción de esta vacuna25. En Francia, un año después de la incorporación de la VNC13, el estado de portador nasofaríngeo de los serotipos 19A, 7F y 6C ha disminuido más del 50% en los niños vacunados, sin que se haya producido un incremento significativo de otros serotipos26.
A la luz de todos los datos epidemiológicos expuestos, la VNC13 cubre hasta el 80% de los serotipos responsables de la ENI en los niños de nuestro país18,19,21,22, por lo que en la actualidad es la vacuna que proporciona una mayor cobertura de serotipos en nuestro medio.
En situaciones de vacunación no sistemática, en los lactantes que inicien la vacunación antineumocócica a los dos meses de edad, debe seguir utilizándose el esquema de inmunización de tres dosis de primovacunación en el primer año de vida, más una dosis de refuerzo en el segundo año (esquema 3+1).
Desde las recomendaciones del calendario de vacunaciones que el CAV realizó en el año 20114 se ha producido un cambio relevante en la ficha técnica de la VNC10, ya que ha visto ampliada la edad aprobada para su aplicación hasta los cinco años27, una franja de edad igual a la de la VNC1327. Para aquellos niños de dos a cinco años que no tengan antecedente de vacunación antineumocócica, es posible vacunarlos con VNC10, si bien precisan dos dosis con una separación de, al menos, dos meses27.
En la Comunidad de Madrid se ha seguido observando cierto desplazamiento de la ENI a edades superiores: 39% en menores de 24 meses; 37% en 24-59 meses y 23% en mayores de 59 meses19. En niños de 24 a 59 meses, la cobertura de la VNC13 para casos de ENI llega a ser de hasta el 87% en nuestro medio, siendo los más frecuentes el serotipo 19A (34%) y el 1 (23%)19. Por todo esto, en niños de hasta 59 meses sin antecedentes de vacunación con VNC13, aunque hayan sido previamente vacunados con VNC7 o hayan recibido una pauta completa con VNC10, el CAV-AEP recomienda la administración de una dosis de VNC13, con un intervalo de, al menos, dos meses desde la última dosis de vacunación antineumocócica, si la hubiere29.
Tabla 2. Mostrar/ocultar
En cuanto a los pacientes con alto riesgo de padecer una ENI (tabla 2)29, como inmunodeprimidos o niños con asplenia orgánica o funcional, se establecen las siguientes recomendaciones: 1) debe utilizarse siempre una pauta 3 + 1; 2) es preceptivo que reciban dos dosis de VNC13 en el segundo año de vida si no han recibido, al menos, dos dosis de la misma en el primer año, y 3) los niños de dos a cinco años sin ninguna dosis previa de VNC13 deben recibir dos dosis separadas por un intervalo mínimo de dos meses. Además, en estos niños debe completarse la inmunización frente a esta bacteria con la administración, a partir de los dos años de edad, de la vacuna antineumocócica polisacarídica de 23 serotipos (VNP23), con un intervalo mínimo de dos meses tras la última dosis recibida de VNC1330. Al cabo de cinco años recibirán la segunda y última dosis de la VNP23. En otros niños no inmunodeprimidos (tabla 3), pero con riesgo alto de padecer infecciones frecuentes o graves por neumococo, puede optarse por seguir las mismas recomendaciones dirigidas a los pacientes de alto riesgo o bien las recomendadas a los niños sanos de su propia comunidad autónoma, y se recomienda que reciban una única dosis de VNP23 a partir de los dos años de edad, con un intervalo mínimo de dos meses tras la última dosis administrada de VNC1330.
Tabla 3. Mostrar/ocultar
Vacunación frente a la varicela
En cuanto a la efectividad de la vacunación, el seguimiento activo de diferentes regiones de EE. UU., donde está instaurada la vacunación universal desde 1995, demostró una disminución sostenida de casos en todos los grupos de edad menores de 45 años, observándose la mayor reducción en el tramo de cero a cuatro años de edad (98%)31. Dicha reducción afectó también a personas no vacunadas, lo que demuestra que esta estrategia de vacunación induce inmunidad de grupo31. De una forma paralela descendieron las hospitalizaciones (hasta un 53%), sobre todo en menores de 14 años31, así como las complicaciones (algunas de las cuales como las infecciones invasoras por Streptococcus pyogenes se asocian, en niños, casi exclusivamente a la varicela)32. En EE. UU. también se documentó recientemente un descenso de la mortalidad en los 12 años siguientes al comienzo de la vacunación universal (1995-2007), ya que la tasa de mortalidad por varicela disminuyó un 88%, desde 0,41/millón de personas entre 1990 y 1994 a 0,05/millón entre 2005 y 2007. La reducción se produjo en todos los grupos de edad, pero la más acentuada tuvo lugar en los menores de 20 años33.
En la Comunidad de Madrid, donde la vacunación universal a los 15 meses de edad se instauró en 2006, se constató una reducción entre 2006 y 2009 del 66% de los casos, así como del 50% de las hospitalizaciones relacionadas con la varicela. La vacunación sistemática demostró inducir inmunidad de grupo, ya que, aunque el mayor porcentaje de reducción de la enfermedad se produjo en el grupo de niños de 0-4 años (86%), también tuvo lugar en niños mayores (5-9 años: 53%; 10-14 años: 73%) y adultos jóvenes (20-24 años: 56%). Hasta el momento no se ha producido un desplazamiento de la enfermedad a la edad adulta34.
En la Comunidad Foral de Navarra, donde se vacuna con dos dosis a los 15 meses y a los tres años, la incidencia de varicela disminuyó un 93,0%, desde 8,04 casos por 1000 habitantes en 2006 a 0,56 por 1000 habitantes en 2010 (p < 0,0001). En los grupos de edad no vacunados se aprecian descensos del 88,2% en los menores de un año, del 73,3% en los de siete a nueve, y del 84,6% en personas mayores de 20 años. En 2006 se produjeron 25 ingresos hospitalarios por varicela en Navarra y en 2009 esta cifra descendió a siete. La tasa de ingresos descendió un 73%. Puede afirmarse que la introducción de la vacunación universal de la varicela en Navarra ha llevado a una disminución rápida y muy pronunciada de la incidencia de la varicela, tanto en vacunados como en no vacunados35.
Analizando todos estos hechos y a la luz de los datos epidemiológicos de las CC. AA. españolas y de los países en los que se ha introducido la vacunación universal contra la varicela, el CAV-AEP considera que la estrategia de vacunación universal con una primera dosis a los 12-15 meses, preferentemente a los 12 meses, y la segunda dosis a los 2-3 años, a ser posible a los dos años, es la más adecuada3. En ambos momentos se recomienda que se administre a la vez que la vacuna TV (ver apartado de TV anteriormente). Se debe recordar que, al ser dos vacunas atenuadas, es recomendable que se administren en sitios anatómicos diferentes y el mismo día, pero si esto no fuera posible, deberán separarse, al menos, un mes entre sí. La segunda dosis es la más efectiva, no solo para evitar el mayor número de casos y sus complicaciones en niños, sino también para asegurar unas coberturas de vacunación superiores al 90%, capaces de prevenir los casos de varicela en adolescentes y adultos.
La vacunación en la primera infancia solo de los niños con riesgo de varicela grave y de sus contactos próximos sanos y la posterior vacunación universal de los adolescentes susceptibles se asocia tradicionalmente a bajas coberturas y podría acentuar el desplazamiento de la enfermedad a la edad adulta.
No obstante, es de interés señalar que en niños con riesgo de varicela grave y en sus contactos próximos sanos, las dos dosis de la vacuna deben administrarse con un intervalo más corto que el propuesto de forma general, con objeto de proporcionarles una protección rápida y evitar los posibles fallos primarios de vacunación. A este respecto, se recomienda que en los menores de 13 años en estas circunstancias, la segunda dosis, si bien puede administrarse al mes de la primera, se administre a partir de los tres meses de esta y en los mayores de esa edad la segunda dosis se administre a partir de un mes de la anterior.
Vacunación frente al rotavirus
El rotavirus ha sido identificado como el principal agente causal de gastroenteritis aguda (GEA) en la infancia a nivel mundial, particularmente en los niños menores de cinco años. La mejor estrategia preventiva contra la enfermedad es la vacunación universal36,37. El objetivo fundamental es proteger frente a las formas graves de GEA, reduciendo la carga de la enfermedad y la utilización de recursos.
Existen dos vacunas frente al rotavirus:
- RotaTeq® es una vacuna pentavalente de cepas bovino-humanas atenuadas reordenadas. La pauta de inmunización consta de tres dosis orales, la primera entre las 6 y las 12 semanas de vida, con un intervalo mínimo de separación de cuatro semanas entre dosis. La edad máxima recomendada para iniciar la primera dosis es de 12 semanas y para aplicar la última dosis es de 32 semanas.
- Rotarix® es una vacuna monovalente de virus atenuados, obtenida de una cepa de virus de origen humano. Se administra también de forma oral, la primera dosis entre las 6-12 semanas de edad, en dos dosis separadas por un intervalo mínimo de cuatro semanas, debiéndose iniciar la pauta como máximo a las 12 semanas y completándose antes de cumplir las 24 semanas de edad (seis meses).
Tras amplios ensayos clínicos precomercialización de las dos vacunas frente al rotavirus, en los que se implicaron a más de 120 000 niños, no se observó asociación entre la invaginación intestinal y ninguna de las dos vacunas ni tampoco se observaron otros efectos adversos clínicamente relevantes41,42.
La OMS y las agencias reguladoras de medicamentos de EE. UU. (Food and Drug Administration [FDA]) y Europa (Agencia Europea de Medicamentos [EMA]), iniciaron un exhaustivo proceso de investigación, poniendo en marcha diversos estudios para evaluar las implicaciones de la presencia de partículas de circovirus porcino en estas vacunas y, de forma unánime, han concluido que no representan un problema para la salud humana, estableciendo que no existe ninguna razón para limitar el uso de las vacunas43-46. En España se encuentran registradas desde 2006 las dos vacunas frente al rotavirus. Ambas siguen estando autorizadas en nuestro país, con las mismas indicaciones y condiciones de uso, si bien tan solo RotaTeq® se encuentra actualmente disponible en los canales de distribución de farmacia, tras la decisión tomada en noviembre de 2010 por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)47.
Teniendo en cuenta la morbilidad y la elevada carga sanitaria que representa la enfermedad, el comité continúa considerando la vacunación frente al rotavirus de todos los lactantes, un incuestionable beneficio para su salud.
Vacunación frente a la gripe estacional
El CAV-AEP considera que la vacunación antigripal es una estrategia especialmente beneficiosa cuando va dirigida a niños mayores de seis meses y adultos que se incluyen en los grupos de población considerados de riesgo, así como sus convivientes y cuidadores. Es especialmente importante la vacunación del entorno familiar cuando existan lactantes menores de seis meses de edad con factores de riesgo, ya que estos no pueden recibir la vacuna antigripal. Igualmente, se insiste en la recomendación de la vacunación antigripal en el personal sanitario que está en contacto con niños.
La información ampliada para esta vacunación puede ser consultada en el documento que el comité elabora anualmente, antes del inicio de la temporada epidémica48. En el citado documento se hace referencia también a la posología, conservación, administración, contraindicaciones, preparados disponibles, nuevas vacunas antigripales, así como recomendaciones sobre vacunación antigripal en niños alérgicos al huevo.
Vacunación frente a la hepatitis A
El CAV-AEP recomienda la vacunación frente a la hepatitis A, como profilaxis preexposición, en los niños mayores de 12 meses con elevado riesgo de infección:
- Viajeros a países con endemicidad intermedia o alta para la infección por el virus de la hepatitis A, especialmente si son niños inmigrantes que visitan sus países de origen
- Residentes en instituciones cerradas y sus cuidadores.
- Niños con síndrome de Down y sus cuidadores.
- Receptores de hemoderivados de forma reiterada
-
Especialmente indicada en niños y adolescentes con mayor riesgo de hepatitis fulminante en caso de infección por el virus de la hepatitis A, como son los siguientes:
- Pacientes en espera de trasplante hepático o enfermos con cualquier hepatopatía crónica.
- Pacientes con serología positiva para el virus de la hepatitis B o C o que estén en tratamiento mantenido con fármacos hepatotóxicos.
Las indicaciones del uso de la vacuna como profilaxis postexposición, en los 14 días siguientes a la misma, incluyen a los contactos domiciliarios de un caso agudo de infección por virus de la hepatitis A y, de forma preferente, ante la presencia de brotes en guarderías.
La pauta de vacunación en ambos tipos de profilaxis consiste en dos dosis, a partir de los 12 meses de edad, con un intervalo de, al menos, 6-12 meses entre dosis3,4,49. Para los viajeros se recomienda que la primera dosis se administre, al menos, un mes antes del viaje a la zona endémica.
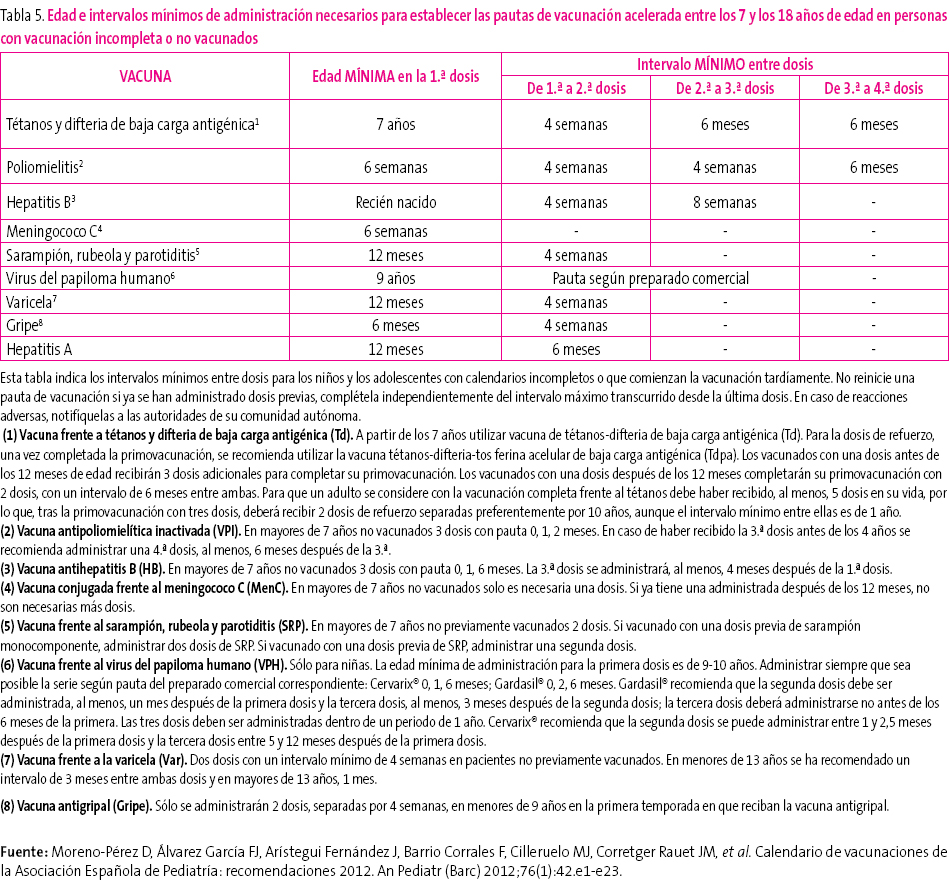
CALENDARIOS ACELERADOS DE VACUNACIÓN PARA NIÑOS Y ADOLESCENTES CON VACUNACIÓN INCOMPLETA
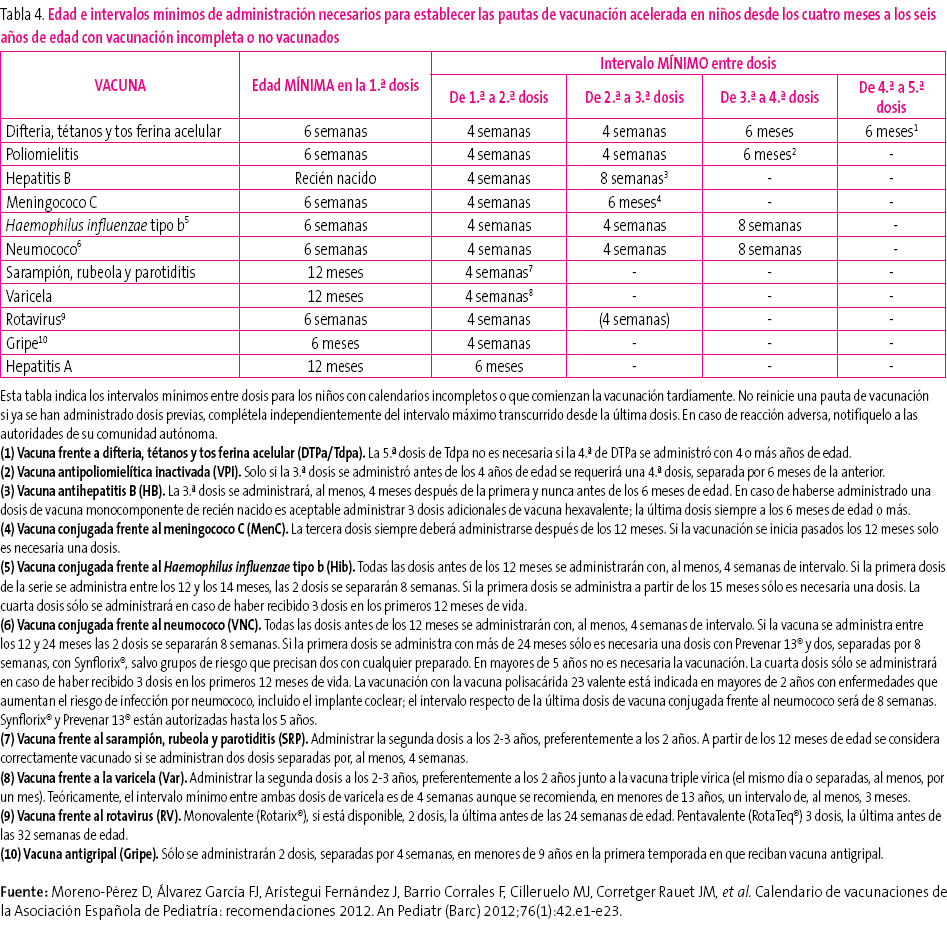
En muchas ocasiones es necesario vacunar a niños que no han recibido vacunas previamente o que no han seguido un calendario de vacunaciones de forma regular, lo han iniciado tardíamente, lo han interrumpido o han sido vacunados en sus países de origen con una pauta diferente a la indicada en España. En todos estos niños se debe realizar una adaptación al calendario de vacunación de nuestro país. El CAV ha elaborado unas tablas (tablas 3-5) para orientar y facilitar la vacunación acelerada en niños y adolescentes con inmunización incompleta. Se pueden consultar en la página web: http://vacunasaep.org/sites/vacunasaep.org/files/CalVac_acelerados_AEP_2012.pdf
Tabla 4. Mostrar/ocultar
Tabla 5. Mostrar/ocultar
Son recomendaciones de diversas sociedades científicas y de expertos y para su interpretación deben tenerse en cuenta las siguientes premisas50:
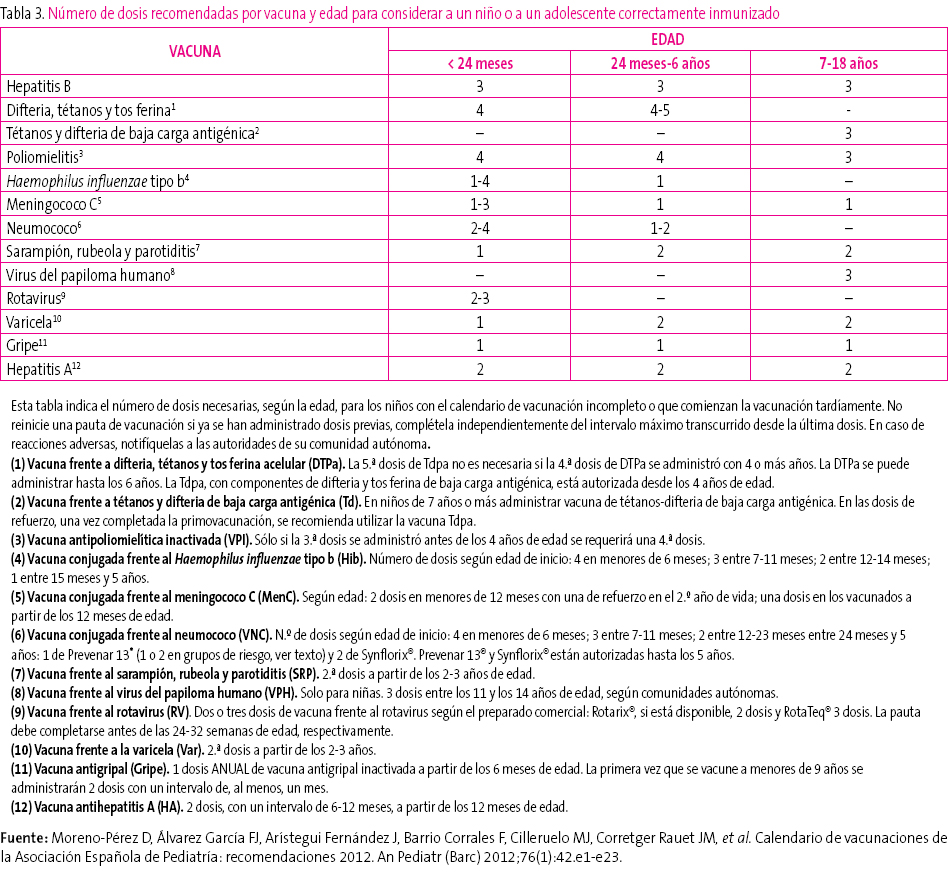
- Edad del niño y, en función de ella, número de dosis necesarias para considerarlo correctamente vacunado (tabla 3). Las dosis administradas previamente, si las hubiese, deben darse por válidas siempre que respeten la edad mínima y el intervalo mínimo entre las dosis para obtener una adecuada respuesta inmunológica y considerar la vacunación como válida. No se reiniciará una pauta de vacunación si el niño ha recibido dosis previas válidas. Para actualizar el calendario se establecerán las dosis necesarias en función de la edad y se restarán las que ya hubiese recibido; el resultado serán las dosis necesarias para poner al día el calendario de vacunas.
- Se considerarán válidas las dosis que estén correctamente registradas o identificadas.
- Se administrarán de forma simultánea todas las vacunas posibles en lugares anatómicos distintos.
- Se administrarán primero las vacunas que inmunicen frente a la patología de mayor riesgo, con relación a la edad del niño y a la epidemiología de su entorno y las que lo inmunicen frente a enfermedades para las que no hubiese recibido ninguna dosis previa de vacuna.
CONFLICTO DE INTERESES DE LOS AUTORES
Francisco José Álvarez García ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD.
David Moreno-Pérez ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD, como investigador en ensayos clínicos de GlaxoSmithKline y como consultor en un Advisory Board de Astra-Zeneca.
Manuel Merino Moína ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD y como investigador en ensayos clínicos de GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD.
BIBLIOGRAFÍA
- Coberturas de vacunación infantil en el año 2010 en España. Ministerio de Sanidad, Servicios Sociales e Igualdad [en línea] [consultado el 20-01-2012]. Disponible en: http://www.msps.es/profesionales/saludPublica/prevPromocion/vacunaciones/coberturas.htm
- Calendario de vacunaciones del Consejo Interterritorial del Sistema Nacional de Salud 2007 [en línea] [consultado el 20-01-2012]. Disponible en: http://www.msps.es/ciudadanos/proteccionSalud/infancia/docs/c2007.pdf
- Moreno-Pérez D, Álvarez García FJ, Arístegui Fernández J, Barrio Corrales F, Cilleruelo MJ, Corretger Rauet JM, et al. Calendario de vacunaciones de la Asociación Española de Pediatría: recomendaciones 2012. An Pediatr (Barc). 2012;76(1):42.e1-e23.
- Marès Bermúdez J, van Esso Arbolave D, Moreno-Pérez D, Merino Moína M, Álvarez García F, Cilleruelo Ortega MJ, et al. Calendario de vacunaciones de la AEP: Recomendaciones 2011. An Pediatr (Barc). 2011;74:132.e1-132.e19.
- Calendarios de vacunación de las ciudades y comunidades autónomas[en línea] [consultado el 20-01-2012]. Disponible en: http://www.aepap.org/vacunas/calvaces.htm
- Centers for Disease Control and Prevention (CDC). Recommended immunization schedules for persons aged 0-18 years-United States, 2011. MMWR. 2011;60:1-4.
- Centers for Disease Control and Prevention (CDC). Updated recommendations for use of tetanus toxoid, reduced diphteria toxoid and acellular pertusis (Tdap) vaccine from the Advisory Committee on the Immunization Practices (ACIP), 2010. MMRW. 2011;60:13-5.
- Vacunación en adultos. Recomendaciones vacunas difteria y tétanos. Actualización 2009 [en línea] [consultado el 20-01-2012]. Disponible en: http://www.msps.es/ciudadanos/proteccionSalud/vacunaciones/docs/TetanosDifteria_2009.pdf
- Healy CM, Rench MA, Baker CJ. Implementation of cocooning against pertussis in a high-risk population. Clin Infect Dis. 2011;52:157-62.
- Conseil Supérieur de la Santé. Vaccination anticoquelucheuse (fichier 8547). Vaccination de l´adulte (2009) [en línea] [consultado el 20-01-2012]. Disponible en: http://www.belgium.be/en/health/
- Instituto de Salud Carlos III, Red Nacional de Vigilancia Epidemiológica. Boletín Epidemiológico Semanal en RED. Información de la enfermedad meningocócica 37/2011[en línea] [consultado el 20-01-2012]. Disponible en: http://www.isciii.es/ISCIII/es/contenidos/fd-servicios-cientifico-tecnicos/fd-vigilancias-alertas/fd-boletines/fd-boletin-epidemiologico-semanal-red/IS-111003-WEB.pdf
- European Centre for Disease Control and Prevention (ECDC). Measles[en línea] [consultado el 20-01-2012]. Disponible en: http://www.ecdc.europa.eu/en/healthtopics/measles/Pages/index.aspx
- Consejería de Salud de la Junta de Andalucía. Secretaría General de Salud Pública y Participación: Servicio de Vigilancia Epidemiológica de Andalucía. Protocolo de Alerta Epidemiológica por Sarampión-adaptado. Última modificación de 24-04-2008. Sevilla, 2011.
- Ficha técnica de Gardasil® [en línea] [EPAR, última actualización: 7-10-2011] [consultado el 20-01-2012]. Disponible en: http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/000703/human_med_000805.jsp&mid=WC0b01ac058001d124
- Chesson HW, Ekwueme DU, Saraiya M, Dunne EF, Markowitz LE. The cost-effectiveness of male HPV vaccination in the United States. Vaccine. 2011;29:8443-50.
- Ficha técnica de Cervarix® [en línea] [EPAR, última actualización: 30-09-2011] [consultado el 20-01-2012]. Disponible en: http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/000721/human_med_000694.jsp&mid=WC0b01ac058001d124
- Wheeler CM, Castellsagué X, Garland SM, Szarewski A, Paavonen J, Naud P, et al. For the HPV PATRICIA Study Group. Cross-protective efficacy of HPV-16/18 AS04-adjuvanted vaccine against cervical infection and precancer caused by non-vaccine oncogenic HPV types: 4-year end-of-study analysis of the randomised, double-blind PATRICIA trial. Lancet Oncol. 2011 Nov 8. [Epub ahead of print]
- Picazo J, Ruiz-Contreras J, Casado-Flores J, Giangaspro E, Del Castillo F, Hernández-Sampelayo T, et al. Relationship between serotypes, age, and clinical presentation of invasive pneumococcal disease in Madrid, Spain, after introduction of the 7-valent pneumococcal conjugate vaccine into the vaccination calendar. Clin Vaccine Immunol. 2011;18:89-94.
- Picazo J, Ruiz-Contreras J, Casado-Flores J, Negreira S, García-de-Miguel MJ, Hernández-Sampelayo T, et al; HERACLES Study Group. Distribution by age of serotypes isolated from pediatric invasive pneumococcal diseases in 2009-2010 in Madrid, Spain. 29th Annual Meeting of European Society for Paediatric Infectious Diseases (ESPID). La Haya, Holanda. 7-11 Junio 2011.
- Hanquet G, Kissling E, Fenoll A, George R, Lepoutre A, Lernout T, et al. Pneumococcal serotypes in children in 4 European countries. Emerg Infect Dis. 2010;16:1428-39.
- Picazo J, Ruiz-Contreras J, Hernández B, Sanz F, Gutiérrez A, Cercenado E, et al. Clonal and clinical profile of Streptococcus pneumoniae serotype 19A causing pediatric invasive infections: a 2-year (2007-2009) laboratory-based surveillance in Madrid. Vaccine. 2011;29:1770-6.
- Muñoz-Almagro C, Esteva C, Fernández de Sevilla M, Selva L, Gene A, Pallarés R. Emergence of invasive pneumococcal disease caused by multidrug-resistant serotype 19A among children in Barcelona. J Infect. 2009;59:75-82.
- Singleton R, Wenger J, Klejka JA, Bulkow LR, Thompson A, Sarkozys D, et al. Impact of the 13-valent pneumococcal conjugate vaccine on invasive pneumococcal disease in Alaska native children: results of a clinical trial. 29th Annual Meeting of European Society for Paediatric Infectious Diseases (ESPID). La Haya, Holanda. 7-11 Junio 2011.
- Health Protection Agency (HPA). Current epidemiology of Invasive Pneumococcal Disease[en línea] [consultado el 20-01-2012]. Disponible en: http://www.hpa.org.uk/Topics/InfectiousDiseases/InfectionsAZ/Pneumococcal/EpidemiologicalDataPneumococcal/CurrentEpidemiologyPneumococcal/
- Moore M, Link-Gelles R, Farley M, Thomas A, Reingold A, Harrison L, et al. Early impact of 13-valent pneumococcal conjugate vaccine on invasive pneumococcal disease among children < 2 years old, U.S, 2010. 51st Interscience Conference on Antimicrobial Agents and Chemotherapy (ICAAC). Chicago, EE. UU. 17-20 septiembre 2011. Abstract G1-538.
- Cohen R, Levy C, Bingen E, Bonnet E, Koskas M, Attal S. Impact of 13-valent pneumococcal conjugate vaccine (PCV13) on nasopharyngeal (NP) flora in children with acute otitis media (AOM). 51st Interscience Conference on Antimicrobial Agents and Chemotherapy (ICAAC). Chicago, EE. UU. 17-20 septiembre 2011. Abstract G3-1709.
- Web de la Agencia Europea de Medicamentos. Ficha técnica de Synflorix [en línea] [última actualización: 25-10-2011] [consultado el 20-01-2012]. Disponible en: http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/000973/human_med_001071.jsp&mid=WC0b01ac058001d124
- Actualización en vacunación antineumocócica. Recomendaciones del Comité Asesor de Vacunas de la Asociación Española de Pediatría[en línea] [consultado el 20-01-2012]. Disponible en: http://vacunasaep.org/documentos/actualizacion-en-vacunacion-antineumococica-2010-recomendaciones-del-comite-asesor-de-vac
- Web de la Agencia Europea de Medicamentos. Ficha técnica de Prevenar13 [en línea] [última actualización: 20-12-2011] [consultado el 20-01-2012]. Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/001104/WC500057247.pdf
- Recommendations of the Advisory Committee on Immunization Practices (ACIP). Prevention of pneumococcal disease among infants and children-Use of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine. MMWR. 2010;59(RR11):1-18.
- Shah SS, Wood SM, Luan X, Ratner AJ. Decline in varicella-related ambulatory visits and hospitalizations in the United States since routine immunization against varicella. Pediatr Infect Dis J. 2010;29:199-204.
- Reynolds MA, Watson BM, Plott-Adams KK, Jumaan AO, Galil K, Maupin TJ, et al. Epidemiology of varicella hospitalizations in the United States, 1995-2005. J Infect Dis. 2008;197:S120-126.
- Marin M, Zhang JX, Seward JF. Near elimination of varicella deaths in the US after implementation of the vaccination program. Pediatrics. 2011;128:214-20.
- Comité Asesor de Vacunas de la Comunidad de Madrid. Servicio Madrileño de Salud. Informe sobre varicela en la Comunidad de Madrid, 2010[en línea] [consultado el 20-01-2012]. Disponible en: http://bit.ly/varicela_madrid_2010
- García Cenoz M, Castilla J, Irisarri F, Arriazu M, Barricarte A. Impacto de la vacunación universal frente a la varicela en Navarra, 2006-2010. An Sist Sanit Navar. 2011;34:193-202.
- Centers for Disease Control and Prevention (CDC). Prevention of rotavirus gastroenteritis among infants and children: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR. 2009;58(RR-2):1-25.
- World Health Organization (WHO). Rotavirus vaccines: an update. Wkly Epidemiol Rec. 2009;84:533-58.
- Buttery JP, Lambert SB, Grimwood K, Nissen MD, Field EJ, McCartney KK, et al. Reduction in rotavirus-associated acute gastroenteritis following introduction of rotavirus vaccine into Australia's National Childhood vaccine schedule. Pediatr Infect Dis J. 2011;30(suppl. 1):25-9.
- Paulke-Korinek M, Kundi M, Rendi-Wagner P, de Martin A, Eder G, Schmidle-Loss B, et al. Herd immunity after two years of the universal mass vaccination program against rotavirus gastroenteritis in Austria. Vaccine. 2011;29:2791-6.
- Martinón-Torres F, Bouzón Alejandro MB, Redondo Collazo LR, Sánchez Lastres JM, Pértega Díaz SP, Seoane Pillado MT, et al. Effectiveness of rotavirus vaccination in Spain. Hum Vaccin. 2011;7:e1-4.
- Vesikari T, Matson DO, Dennehy P, Van Damme P, Santosham M, Rodríguez Z, et al. Safety and efficacy of a pentavalent human-bovine (WC3) reassortant rotavirus vaccine. N Eng J Med. 2006;354:23-33.
- Ruiz-Palacios GM, Pérez-Shael I, Velázquez R, Abate H, Breuer T, Costa-Clemens SA, et al. Safety and efficacy of an attenuated vaccine against severe rotavirus gastroenteritis. N Eng J Med. 2006;354:11-22.
- Rotavirus vaccination–WHO does not recommend any change to use of Rotarix vaccine[en línea] [consultado el 20-01-2012]. Disponible en: http://www.who.int/immunization/newsroom/news_rotavirus_vaccine_use/en/index.html
- FDA Revises Recommendations for Rotavirus Vaccines [en línea] [consultado el 20-01-2012]. Disponible en: http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/2010/ucm212149.htm
- European Medicines Agency confirms positive benefit-risk balance of Rotarix. Porcine circovirus type 1 in the oral vaccine poses no risk to public health [en línea] [consultado el 20-01-2012]. Disponible en: http://bit.ly/EMA_beneficio-riesgo_rotarix
- European Medicines Agency confirms positive benefit-risk balance of RotaTeq [en línea] [consultado el 20-01-2012]. Disponible en: http://www.ema.europa.eu/ema/index.jsp?curl=pages/news_and_events/news/2010/09/news_detail_001121.jsp&murl=menus/news_and_events/news_and_events.jsp&mid=WC0b01ac058004d5c1&jsenabled=true
- Nota informativa: Liberación de lotes de la vacuna RotaTeq®. AEMPS, 4 noviembre 2010 [en línea] [consultado el 20-01-2012]. Disponible en: http://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/calidad/2010/NI-circovirus-rotateq_noviembre-2010.htm
- Moreno-Pérez D, Arístegui Fernández J, Ruiz-Contreras J, Álvarez García FJ, Merino Moína M, González Hachero J, et al. Recomendaciones de vacunación frente a la gripe 2011-2012 del Comité Asesor de Vacunas de la Asociación Española de Pediatría. An Pediatr (Barc.) 2012;76(1):44.e1-e5.
- American Academy of Pediatrics. Committee on Infectious Diseases. Hepatitis A vaccine recommendations. Pediatrics. 2007;120:189-99.
- Centers for Disease Control and Prevention (CDC). Catch-up immunization schedule for persons aged 4 months through 18 years who start late or who are more than 1 month behind [en línea] [consultado el 20-01-2012]. Disponible en: http://www.cdc.gov/vaccines/recs/schedules/downloads/child/catchup-schedule-pr.pdf
Cómo citar este artículo
Artículos relacionados
 Nuevas recomendaciones del calendario de vacunaciones de la Asociación Española de Pediatría 2012. Calendario de vacunación único (1.ª parte)
Nuevas recomendaciones del calendario de vacunaciones de la Asociación Española de Pediatría 2012. Calendario de vacunación único (1.ª parte)
Álvarez García F J. Nuevas recomendaciones del calendario de vacunaciones de la Asociación Española de Pediatría 2012. Calendario de vacunación único (1.ª parte). Form Act Pediatr Aten Prim. 2012;5;19-26