Novedades y perspectivas futuras en vacunación infantil
RESUMEN
El descubrimiento de las vacunas preventivas hace dos siglos fue un hito en la historia de la Medicina. En las últimas décadas, los avances en el campo de la Vacunología se han multiplicado y han sido espectaculares. Abordaremos someramente algunos de estos avances y trataremos de mostrar hacia dónde se dirigen las investigaciones en la actualidad. Detallaremos algunos aspectos sobre las últimas novedades en vacunas para prevenir enfermedades que puedan tener mayor relevancia en Pediatría, especialmente en nuestro medio: meningococo B, VIH, tuberculosis, tosferina, virus respiratorio sincitial y neumococo. También hablaremos de la malaria y esbozaremos el panorama en algunas otras enfermedades infecciosas.
PUNTOS CLAVE
- En las últimas décadas, los avances en el campo de las vacunas han sido espectaculares, pero queda mucho camino por recorrer.
- Los avances en Genética, con la secuenciación completa del genoma de los microorganismos, abren unas perspectivas hasta ahora insospechadas.
- Estamos a las puertas de disponer de dos nuevas vacunas frente al meningococo B, válidas para cualquier cepa.
- Para el año 2015, se espera que podamos disponer también de una vacuna eficaz frente a la malaria.
- Los avances para lograr una vacuna preventiva frente al VIH son lentos pero prometedores a partir de los estudios realizados en Tailandia.
- Se espera que en 2012 se inicie el ensayo clínico en humanos con la nueva vacuna española frente a la tuberculosis.
- La principal dificultad para lograr una vacuna frente al virus sincitial respiratorio es soslayar la interferencia de los anticuerpos maternos, dada la corta edad de la población diana.
- Se investiga en proteínas de membrana para conseguir una vacuna universal frente a todos los serotipos de neumococo.
INTRODUCCIÓN
En 1796, Edward Jenner realizó la primera inoculación con el virus de la viruela vacuna en un niño de ocho años, quedando este hecho marcado como un hito para la historia de la Medicina. Desde entonces, se han ido sucediendo los avances en el campo de las vacunas de forma exponencial y en las últimas décadas, impulsados por los avances en Genética, se han acelerado de forma espectacular. En este artículo abordaremos someramente algunos de los recientes avances en Vacunología y trataremos de mostrar hacia dónde se dirigen sus investigaciones en la actualidad. Detallaremos solo algunos aspectos de los que puedan tener mayor relevancia en Pediatría.
Actualmente se estudian nuevas vías de administración, como la mucosa, la sublingual, la intranasal o la transcutánea (parches), que faciliten la inmunización de forma rápida a grandes grupos poblacionales, a la vez que mejoren su aceptabilidad por parte de los receptores1. Muchos de estos estudios se han realizado con la vacuna de la hepatitis B. Uno de ellos presenta con éxito una emulsión de gotas microscópicas para administración intranasal. La nanovacuna, que podría resolver los problemas de almacenamiento, conservación y distribución en los países pobres, consiste en gotas de menos de 400 nanómetros de diámetro y podría ser segura y eficaz para primovacunación y como método alternativo de refuerzo de las vacunas existentes.
Otro campo prometedor son las vacunas comestibles utilizando vegetales genéticamente modificados. Una de sus ventajas es reducir el número de pinchazos y mejorar su aceptación por los niños. Se selecciona el material genético responsable de la actividad antigénica del microorganismo y se inserta en el genoma de plantas comestibles. El resultado son alimentos transgénicos que estimularían el sistema inmunitario al ser consumidos. Como deben ser ingeridos crudos para evitar la desnaturalización de la vacuna por efecto del cocinado, el plátano parece ser el más adecuado.
Se investiga la posibilidad de nuevas combinaciones de vacunas ya existentes que reduzcan el número de pinchazos necesario sin menoscabo de la eficacia vacunal, y sobre nuevas inmunizaciones preventivas frente a patógenos para los cuales no disponíamos de ellas, como el herpes genital, o mejorando las ya existentes frente a los clásicos, como pueden ser la tuberculosis o el paludismo, de las que nos ocuparemos después.
Pueden servir también como ejemplo los estudios actuales para conseguir una vacuna eficaz frente al meningococo B. Dado que su polisacárido capsular ha resultado ser muy poco inmunógeno, se centran en las proteínas de membrana externa (OMP) de las que hablaremos más adelante. Otro tipo de vacunas para este germen son las llamadas “a la carta”, diseñadas contra las cepas más prevalentes de una zona concreta, como ya se ha hecho en Francia y Nueva Zelanda. Sobre la base de estos estudios se intenta conseguir vacunas polivalentes que provoquen una mayor reactividad cruzada y protejan frente al mayor número posible de cepas de meningococo B.
Se trabaja buscando nuevos adyuvantes e inmunomoduladores para potenciar el efecto de los antígenos, como es el caso de algunos que ya se utilizan en vacunas frente a la gripe pandémica y el papilomavirus.
En cuanto a la preparación de antígenos, se ensayan múltiples técnicas que van desde la atenuación de gérmenes vivos, pasando por la fabricación de partículas similares a virus (envueltas vacías de material genético) o la creación de péptidos sintéticos o modificados por ingeniería genética, a la identificación de las partículas generadoras de inmunidad protectora y los diversos modos de vehiculación de las mismas mediante virosomas, plásmidos o vectores vivos. Se intenta desarrollar compuestos que estimulen tanto la vía celular como la humoral del sistema inmunitario generando respuestas más eficaces y duraderas.
Otras líneas de investigación se basan en la secuenciación completa del genoma de un microorganismo para tratar de identificar, mediante programas informáticos, genes que codifiquen antígenos con capacidad potencialmente generadora de inmunidad protectora. Es lo que se denomina vacunología inversa y se está haciendo con el Plasmodium y con en meningococo B, entre otros.
Otro campo de investigación dirige sus esfuerzos a mejorar la respuesta inmune persistente: aquella que se mantiene en el tiempo a pesar de que ya no exista contacto con el antígeno. Algunos subtipos de linfocitos T juegan un papel preponderante en este tipo de respuesta y son estimulados por determinadas interleucinas. Se trataría de administrar estas junto con la vacuna.
Otros avances se han producido en relación al momento de aplicación de las vacunas ya existentes. Actualmente, a tenor de los últimos brotes de sarampión ocurridos en toda la región europea, se propone el adelanto de la primera dosis de la vacuna triple vírica a los 12 meses y de la segunda dosis a los dos años de edad. Otras recomendaciones avaladas por la AEP son el adelanto de la primera dosis de la vacuna frente a la varicela a los 12 meses y la segunda a los 2 años, coincidiendo con la vacuna triple vírica, y la implantación de la Tdpa (tétanos más difteria y tosferina acelular de baja carga antigénica) a los 6 y a los 13 años.
Por último, concretamente en España, podemos constatar que donde no se logran avances es en el anhelado proyecto de la unificación de los programas de vacunación autonómicos con el objetivo de un calendario de vacunación único para todo el territorio nacional, habida cuenta que es algo que no depende de los avances científicos sino de motivaciones políticas.
MENINGOCOCO B
Neisseria meningitidis es una bacteria gramnegativa aerobia estricta rodeada de una cápsula de naturaleza polisacárida cuya diferente composición permite distinguir 13 serogrupos: A, B, C, D, 29E, H, I, K, L, W135, X, Y y Z. Desde 1950 no se ha vuelto a aislar ningún meningococo D, por lo que algunos autores dudan de su existencia. También puede clasificarse en 20 serotipos y 11 subserotipos, independientes del serogrupo, en función de la especificidad antigénica de las proteínas de la membrana exterior. Por último, se distinguen también 12 inmunotipos según la cadena distal del lipopolisacárido. El comportamiento epidemiológico de la infección meningocócica está asociado estrechamente al serogrupo predominante de Neisseria meningitidis. Los más relevantes son el A, el B y el C, seguidos del Y, el W135 y el resto. El serogrupo A causa importantes epidemias en el cinturón subsahariano y otras áreas del mundo en desarrollo; el serogrupo B suele relacionarse con una mayor presencia de casos esporádicos en muchos países desarrollados, y el serogrupo C, cuya incidencia ha ido aumentando en las últimas décadas en algunos países, incluida España, produce sobre todo brotes y, ocasionalmente, epidemias. En el momento actual disponemos en España de una vacuna conjugada eficaz y segura frente a meningococo C incluida en el Calendario Vacunal y podemos acceder a través de medicación extranjera, para los casos que lo requieran, a la tetravalente conjugada A-C-Y-W135. Sin embargo, seguimos a la espera de una vacuna eficaz frente al meningococo B, aunque se anuncian novedades en breve.
El meningococo B se presenta en situaciones endémicas con un 5-10% de la población (especialmente adolescentes) como portadores sanos, con cepas muy heterogéneas, si bien en los últimos años se ha mantenido relativamente estable la presencia de un 30-40% de las cepas B:4:P1.15. Además, cada cierto tiempo se presenta como situaciones epidémicas o brotes cuando aparece un serotipo predominante, como por ejemplo el B:4:P1.7-2,4. Los problemas de brotes se han ido solventando temporalmente con las llamadas vacunas a la carta de las que hablábamos en la introducción. Pero la gran variabilidad genética y antigénica de esta bacteria es lo que hasta ahora ha impedido conseguir una vacuna antimeningocócica B de tipo universal.
Las posibilidades de desarrollo de vacunas frente a meningococo B que se han planteado son frente a antígenos capsulares y no capsulares. Las primeras resultan poco inmunógenas y pueden presentar riesgo de autoinmunidad, mientras que las segundas ofrecen protección solo para cepas homólogas debido a la gran variabilidad antigénica, provocan una pobre respuesta en lactantes y la inmunidad resultante es poco duradera, con necesidad de dosis repetidas2.
En estos momentos, gracias a la secuenciación completa del genoma del meningococo B y a la Vacunología inversa, estamos a las puertas de recibir dos nuevas vacunas: LP2086 de Pfizer y 4CMenB de Novartis.
La vacuna LP2086 se basa en la fHbp, una lipoproteína nativa obtenida por técnicas recombinantes expresadas en Escherichia coli y después purificada. Existen dos familias de LP2086, la A05 y la B01, y la vacuna contiene una mezcla bivalente de ambas. Ya se están realizando ensayos clínicos de fase III en adolescentes y de fase I en lactantes y se espera su presentación a la Agencia Europea de Medicamento (EMA) para este año 20123,4.
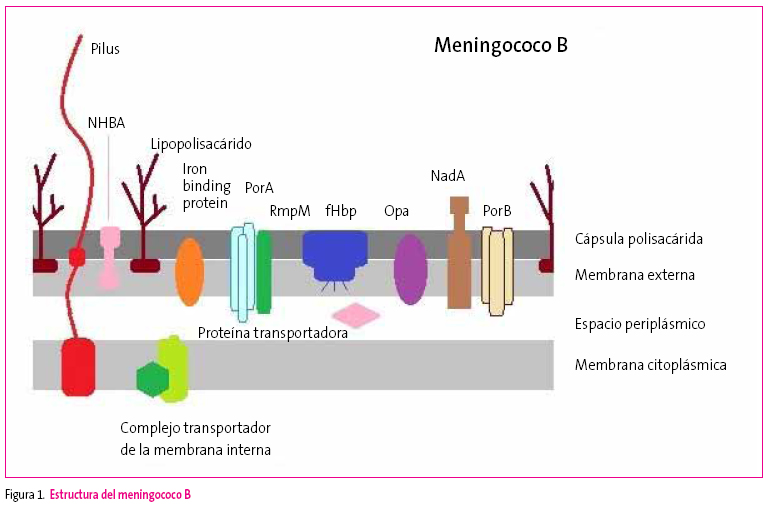
La otra vacuna, 4CMenB, está en ensayos clínicos fase III en adolescentes, fue presentada a la EMA en diciembre 2010 y acaba de autorizarse en noviembre de 2012. Se basa en cuatro componentes antigénicos: NadA, fHbp, NHBA y PorA, todos ellos importantes para la supervivencia, función o virulencia del meningococo (Figura 1).
Figura 1. Mostrar/ocultar
La NadA es la neisserial adhesin A, que favorece la unión y penetración del meningococo en las células epiteliales y parece tener un posible papel en el estado de portador. La fHbp o factor H binding protein inhibe in vitro la vía alternativa del complemento e induce respuesta de anticuerpos en humanos. La NHBA o neisserial heparinbinding antigen está presente en casi la totalidad de las cepas de meningococo B y se une a la heparina, aumentando la resistencia de la bacteria. Por último, la PorA es la porina A, una proteína de las vesículas de la membrana externa, que ha demostrado inducir una potente respuesta humoral.
En los estudios clínicos en niños a partir de dos meses de edad, se ha comprobado una buena inmunogenicidad y ofrece una protección frente al 78% de las cepas de meningococo B circulantes en Europa. El perfil de seguridad es bueno, con aceptable tolerabilidad, con dolor en el punto de inyección como efecto secundario más relevante.5 Así pues, se espera que en breve pasemos de no tener nada a tener opciones donde escoger.
MALARIA
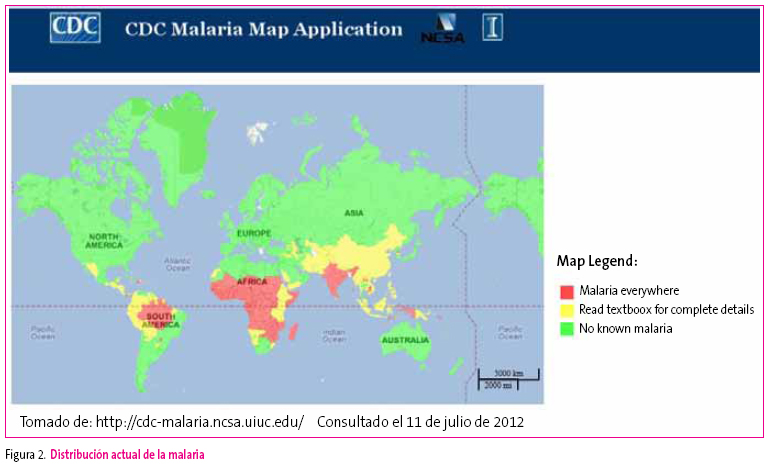
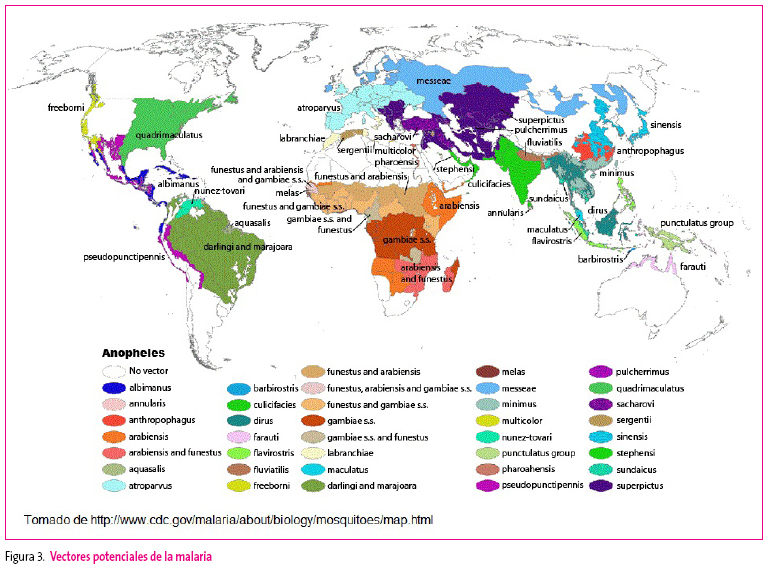
El paludismo o malaria es una enfermedad parasitaria causada por el Plasmodium que se transmite a través de la picadura del mosquito Anopheles, que actúa como vector. Más de la mitad de la población mundial vive en zonas endémicas de paludismo, registrándose cada año entre 300 y 500 millones de episodios de malaria y más de un millón de muertos. Hace más de medio siglo que esta enfermedad fue erradicada en España, aunque cada vez se reciben más casos importados debido a la inmigración. La distribución actual de la malaria y sus posibles vectores puede verse en las Figuras 2 y 3.
Figura 2. Mostrar/ocultar
Figura 3. Mostrar/ocultar
Se han hecho grandes esfuerzos para conseguir una vacuna eficaz y que a la vez sea barata y fácil de administrar. Al tratarse de un parásito mucho más complejo que cualquier virus o bacteria y pasar en su desarrollo por diversos estadios (esporozoíto, merozoíto y gametozoíto), presenta una enorme variabilidad antigénica.
Se requeriría una vacuna que generase inmunidad secuencial frente a todas las fases del ciclo vital del plasmodio y frente a los antígenos esenciales (para que pudiese detener su desarrollo) que, por el momento, no se conoce con certeza cuáles son6. Se trataría de inducir el tipo adecuado de respuesta inmune. Aún tenemos un conocimiento insuficiente de cómo se adquiere la inmunidad frente a la malaria, pero se sabe que cada estadio parasitario determina qué tipo diferente de respuesta es la óptima para su destrucción: de células T CD8 y/o CD4 tipo 1 para las formas hepáticas intracelulares, anticuerpos neutralizantes para el bloqueo de la transmisión por el vector o estos mismos anticuerpos en concentraciones elevadas junto con algún tipo de respuesta celular dependiente de anticuerpos para eliminar el estadio eritrocitario.
Muchos estudios con esporozoítos irradiados7 han dado buenos resultados en roedores, monos y seres humanos. Se supone un mecanismo de tipo celular T contra múltiples antígenos parasitarios expresados en la superficie de los hepatocitos infectados y que el resultado global debe ser la suma de un conjunto de pequeñas respuestas inmunes a ese variado grupo antigénico8. Los individuos vacunados que eran infectados posteriormente por esporozoítos viables presentaron una inmunidad completa en alrededor del 90% de los casos, aunque de duración limitada.
Es conocido que existen individuos en las zonas endémicas que desarrollan a lo largo de su vida una inmunidad natural adquirida parcial que les protege de las formas graves de enfermedad. Los que alcanzan una inmunidad natural pueden volver a ser reinfectados si se erradica el parásito en ellos con tratamiento, lo que indica que esa inmunidad natural no es total. Este tipo de respuesta es humoral, como lo demuestra la protección de los niños por transferencia pasiva de anticuerpos.
Es decir, para obtener una eficacia óptima deberíamos inducir ambos tipos de respuesta, celular y humoral.
Aunque existen más de 100 líneas de investigación, la mitad de las investigaciones actuales se centran en tres antígenos clonados: la proteína del circumsporozoíto (CSP), la proteína del merozoíto (MSP) y el antígeno de membrana apical (AMA-1). Con ellos se están desarrollando distintas vacunas preeritrocíticas (antígeno CSP y otros), eritrocíticas (antígenos MSP y AMA1 y otros) y otras con antígenos de ambos estadios.
También se ensayan otros tipos de vacunas llamadas de bloqueo de transmisión del gametocito con antígenos procedentes del Plasmodium vivax, y se mantiene la línea de investigación pionera con plasmodios vivos atenuados.
Con la reciente descodificación completa del genoma del Plasmodium falciparum, se han identificado cientos de nuevas proteínas y se abren nuevas vías de investigación.
Finalmente, se están utilizando distintos adyuvantes para potenciar la respuesta inmune, aparte del clásico hidróxido de aluminio, como el AS02, el montanide ISA 720 y el GM-CSF DNA. Un estudio publicado en 2010 en el Journal of Infectious Diseases, realizado en 2022 niños de Mozambique de entre uno y cuatro años, demostró por primera vez que la vacuna basada en la RTS,S con adyuvante AS02A es segura y capaz de reducir los episodios clínicos de malaria un 30% y los casos de malaria grave un 38% durante al menos 45 meses después de su administración9. A partir de entonces, se han ido obteniendo nuevos resultados esperanzadores. Se han publicado cinco estudios clínicos aleatorizados y cuatro estudios de extensión de seguimiento10. Los estudios fase 2, presentaron una tasa de eficacia de un 33-65% en lactantes y un 30-53% en niños para la prevención del primer episodio clínico de la enfermedad. En los ensayos fase 3, la eficacia de la vacuna fue del 56% en niños de 5-17 meses11. En resumen, la vacuna RTS,S ha demostrado eficacia y seguridad en los estudios de fase 1, 2 y 3 y tiene el potencial de disminuir la morbilidad y mortalidad de la malaria en el mundo. Falta por determinar la duración de la inmunidad, evaluar su coste-efectividad y su empleo en poblaciones especiales. Pendiente de estos estudios, la vacuna RTS,S tiene la posibilidad de convertirse en la primera vacuna de referencia efectiva contra la malaria y se espera su aprobación definitiva para el año 2015. Además, parece ser que GlaxoSmithKline (GSK) asume un compromiso de limitar sus ganancias para hacerla asequible a los países pobres, aquellos que precisamente la necesitan.
Virus de la inmunodeficiencia humana
El virus de la inmunodeficiencia humana (VIH-1) es un lentivirus miembro de la familia Retroviridae, a la que también pertenecen el VIH-2, el VIS (simios) y el VIF (felinos). Inicialmente se clasificó en dos categorías: SI y NSI, según la capacidad de infectar a linfocitos T4 o a macrófagos, respectivamente, y de producir o no sincitios. Los que presentaban tropismo por ambas líneas celulares se denominaron dual-trópicos. Esta clasificación es confusa y actualmente se denominan X4 si utilizan el receptor CXCR-4 para infectar a los linfocitos T, y R5 si utilizan el CCR-5 para infectar a los macrófagos. También pueden clasificarse según las secuencias genéticas del virus en M (principal), N (nuevo) y O (el resto, no clasificable). Dentro del grupo principal M se dividen en subtipos denominados con las letras de la A a la K.
La pandemia originada hace 30 años y causada por el VIH-1 continúa afectando a unos 40 millones de personas en el mundo según la OMS, con 14 000 nuevas infecciones diarias y con más de 22 millones de muertes desde su aparición. Aunque los antirretrovirales pueden controlar la infección, la dificultad para aplicarlos en los países pobres y el hecho de que el virus mute con rapidez y se haga resistente obliga a desarrollar una vacuna eficaz contra el VIH-1. Para alcanzar estos objetivos se necesita un esfuerzo global con un mayor incremento en la diversidad de los esfuerzos en I+D de vacunas contra el síndrome de inmunodeficiencia adquirida (SIDA). Durante la cumbre del Grupo de los 8 (G-8) en 2005, los Estados miembros se comprometieron a incrementar su apoyo y suscribieron el concepto de una “Global AIDS Vaccine Enterprise”, o “Iniciativa Global para las Vacunas del SIDA”. En 2006, la Fundación Bill y Melinda Gates anunció la concesión de 16 proyectos de investigación sobre vacunas del VIH/SIDA con un importe de casi 300 millones de dólares. Otros organismos como la International Aids Vaccine Initiative (IAVI) se esfuerzan en impulsar las investigaciones. Aunque ha habido progresos notables, aún no se ha conseguido una vacuna con probada eficacia clínica.
Las principales dificultades son la identificación de determinantes mayores de inmunogenicidad que fuesen comunes para todos los virus, independientemente del HLA-I del individuo infectado; la definición de marcadores subrogados de protección, pues no se conoce qué parte de la respuesta inmune celular y humoral frente al VIH es la que resulta protectora, y los múltiples mecanismos de escape viral: variabilidad genética, mutaciones en los epitopos que reconocen los linfocitos CD8 y especial estructura de la envuelta viral que los oculta con estructuras de hidratos de carbono llamadas escudos glicanos, así como la rapidez en el establecimiento de la infección y la posibilidad de latencia y reactivación.
Se han ensayado todo tipo de vacunas. Las basadas en virus vivos requieren un alto grado de atenuación para evitar su persistencia y su reversión a cepa virulenta, lo que merma la respuesta inmune. Las de virus enteros inactivados producen una pobre respuesta inmune. Las más estudiadas son las que utilizan partículas virales de la envuelta y ya hay estudios en fase III. Otras se basan en partículas no estructurales, como la proteína reguladora Tat, que es necesaria para que se complete la replicación viral. Se han desarrollado intentos con vacunas atenuadas recombinantes con vectores vivos tanto víricos (vaccinia, canarypox, fowlpox, adenovirus 5, sarampión, polio atenuado, virus Sendai y otros) como bacterianos (BCG, Salmonella). Hay ensayos prometedores utilizando la vía inhalada con vectores de poxvirus (estirpes atenuadas MVA y NYVAC) como posibles candidatos vacunales contra los subtipos B y C del VIH, que son los de mayor prevalencia12. Utilizando los sistemas de expresión de virus vaccinia y baculovirus recombinantes, se trabaja en vacunas de partículas víricas exentas de genoma o pseudoviriones que incluyen los antígenos proteicos Gag y Env, que están resultando altamente inmunógenas y en vacunas híbridas utilizando poliovirus que expresaban en su superficie partículas del VIH.
También se ensaya con vacunas terapéuticas para el control de la infección ya establecida.
Los resultados, de momento, no son los esperados. En octubre de 2007, dos ensayos experimentales para una vacuna conocidos como STEP (HVTN 502) y Phambili (HVTN 503) tuvieron que ser suspendidos tras una larga serie de alrededor de 50 intentos frustrados y se generó bastante polémica acerca de si merecía la pena dedicar tanto dinero en investigar una vacuna, en lugar de dedicarlo a tratamiento y prevención. A pesar de todo, se han seguido poniendo en marcha nuevos proyectos para lograr una vacuna y en octubre de 2009 se publicó un trabajo esperanzador. Supachai Rerks-Ngarm, del ministerio tailandés de Salud, con la colaboración del gobierno de EE. UU. y dos compañías farmacéuticas, Sanofi-Pasteur y la Global Solutions for Infectious Diseases, obtuvieron un importante avance. Fue necesario combinar dos estrategias que no habían funcionado por separado para obtener por primera vez una vacuna contra el VIH que parece eficaz. Dieciséis mil voluntarios (hombres y mujeres de toda condición de 18 a 30 años) fueron vacunados en Tailandia desde octubre de 2003 con dos tipos de vacuna: cuatro dosis de ALVAC (vehiculada por virus canarypox para estimular la inmunidad celular) y dos más de AIDSVAX (que utiliza una proteína del VIH purificada para lograr generar anticuerpos). Se obtuvo una reducción del 30% en la infección, aunque quedan por explicar algunas cuestiones que aún no se han podido aclarar: por qué las personas que se infectaban a pesar de estar vacunadas tenían la misma carga viral que el grupo placebo y si la vacuna será eficaz contra varios tipos de cepas del VIH, además de las empleadas en este caso, la B (más habitual en Europa) y la E (mayoritaria en Tailandia)13. Actualmente se sigue investigando y analizando las muestras obtenidas de Tailandia para mejorar la pauta original de administración de la esta vacuna con el fin de conseguir un efecto más amplio, potente y duradero.
Algunos investigadores de laboratorios financiados por el National Institute of Allergy and Infectious Diseases (NIAID) de EE. UU. están trazando un nuevo rumbo, al diseñar vacunas contra el VIH basadas en los conocimientos de la estructura proteínica de las espinas superficiales que el VIH usa para fijarse a las células humanas al infectarlas. Estas espinas tienen sitios a los que pueden fijarse los anticuerpos y bloquear la infección de las células humanas in vitro en más del 90% de las cepas de VIH evaluadas. La intención es crear una vacuna que pueda estimular la síntesis de anticuerpos neutralizantes de amplio espectro en personas sanas.
Otros investigadores, apoyados también por el NIAID, parten de la observación de que en la mayoría de las personas solo un reducido número de partículas del VIH, incluso solo una, son responsables de que se establezca la infección. Sus esfuerzos se dirigen a identificar las cualidades especiales que hacen que estas determinadas formas de virus sean capaces de burlar las defensas del cuerpo y causar infección para poder fabricar nuevas vacunas dirigidas específicamente contra esas variantes del virus.
Aún queda un largo camino, pero los avances son prometedores.
TUBERCULOSIS
“Complejo Mycobacterium tuberculosis” es la denominación que recibe el taxón de micobacterias formado por cuatro especies: Mycobacterium tuberculosis, M. bovis, M. africanum, y M. microtti. Cualquiera de ellas puede ser causa de la enfermedad tuberculosa (TB). Podría incluirse también al bacilo de Calmette-Guérin (BCG), microorganismo a partir del cual se elabora la actual vacuna BCG. Se espera que la secuenciación genómica de M. tuberculosis permita diferenciar mejor a los integrantes de este grupo.
Son bacilos aerobios estrictos muy resistentes al frío, la desecación y la congelación, y por el contrario muy sensibles al calor y la luz ultravioleta. Su multiplicación es muy lenta (14-24 horas) y ante circunstancias adversas puede entrar en un estado "durmiente". El reservorio fundamental es el hombre y la fuente de infección la constituye casi exclusivamente el hombre enfermo.
En la actualidad, se estima que dos mil millones de individuos en el mundo están infectados, pero solo en un 10% de ellos la infección se transforma en enfermedad tuberculosa activa14. La TB está presentando nuevos retos como problema global de salud, especialmente con nuevas amenazas como la coinfección con VIH y la selección de cepas de micobacterias multirresistentes. La vacuna actual BCG es ampliamente utilizada a nivel mundial, pero su eficacia frente a la TB pulmonar en adultos en muchos países de alta incidencia es limitada aunque no despreciable15. Dadas las diferentes necesidades que existen dentro de una población en la que conviven individuos se han inmunizado previamente con BCG o no, con otros con infección TB latente, enfermos o que nunca tuvieron contacto con el bacilo de Koch, junto con algunos coinfectados con el VIH, se requieren diversas estrategias vacunales. En los últimos 15 años se están llevando a cabo nuevos proyectos para mejorar o reemplazar a la BCG que están siendo probados en modelos animales y en humanos. La gran diversidad de cepas de BCG y la sobreatenuación de las vacunas actualmente en uso obligan a buscar nuevos preparados. El estado actual del desarrollo de estos trabajos es muy esperanzador y algunas de estas nuevas vacunas podrían ser recomendadas eventualmente para viajeros a países con alta carga de enfermedad tuberculosa. Varias están actualmente en ensayos en humanos y algunas han entrado en fase III de estudios de eficacia. Como se muestra en las recientes revisiones de Ly y McMurray16 y de Hoft17, hay una amplia variedad de tipos de vacunas, incluyendo de subunidades (antígenos adyuvados, ADN desnudo o con un transportador recombinante que exprese un antígeno de TB), de micobacterias enteras mutantes, de rBCG recombinantes con expresión de citolisina o citocina o con sobreexpresión de antígeno, y otras de Mycobacterium tuberculosis, ya sea recombinantes o mutantes, llamadas combinadas, que coexpresan el antígeno bacteriano junto con un inmunomodulador18. Otras se presentan vectorizadas por virus. En algunas de ellas existen dudas sobre su seguridad. Se presta también atención a las estrategias de administración no inyectable, incluyendo la inmunización por vía mucosa y la oral19, que mejorarían la aceptabilidad y abaratarían los costes.
Por último, reseñamos una investigación coordinada por la Universidad de Zaragoza, que ha desarrollado una vacuna viva que ha demostrado ser más eficaz que la actual BCG en ensayos preclínicos. Al haber identificado una compleja red de virulencia bajo el control de una única proteína llamada phoP, han logrado eliminar el gen que la codifica en el Mycobacterium tuberculosis. Los resultados han sido publicados en noviembre de 2008 en la revista PLoS ONE20. Con el apoyo de la Fundación Bill y Melisa Gates ya están preparadas 10 000 dosis fabricadas por la farmacéutica gallega Biofabri y los investigadores esperan comenzar los ensayos clínicos en 2012.
VIRUS RESPIRATORIO SINCITIAL
El virus respiratorio sincitial (VRS) es la principal causa de infección pulmonar en lactantes y niños en todo el mundo. La enfermedad por el VRS se produce estacionalmente en ambas poblaciones, pero su gravedad es máxima durante la lactancia y especialmente si concurren factores de riesgo cardiopulmonar.
Los anticuerpos monoclonales palivizumab pueden ser útiles en la prevención, pero su coste es muy elevado.
Actualmente no hay vacunas disponibles contra el VRS. Esto se debe en parte a diversos aspectos relacionados con la edad. La inmadurez inmunológica de los lactantes es un factor fundamental a tener en cuenta en las investigaciones sobre la elaboración de una vacuna. No se ha establecido la capacidad para inducir respuestas inmunes protectoras y de larga duración en forma segura tanto en los niños sanos como en los grupos más vulnerables (prematuros, displasia broncopulmonar, asma). Otro problema añadido es la obtención de una inmunidad específica protectora sin que interfiera la presencia de anticuerpos maternos en los primeros meses de vida. Además, la vacuna debe proteger frente a los grupos A y B del virus. Por último, dado que los niños que han padecido la enfermedad natural pueden reinfectarse, es probable que se precisen varias dosis para obtener una protección eficaz.
En los años 60 se utilizó una vacuna inactivada con formol que no solo no resultó eficaz sino que las consecuencias de la infección natural en los vacunados resultaron mucho más graves, registrándose algunas muertes. Probablemente fue debido a que la vacuna generaba un respuesta fundamentalmente tipo T helper 2. Hasta ahora, ninguna de las estrategias convencionales para la elaboración de una vacuna ha demostrado la combinación necesaria de seguridad e inmunogenicidad contra el VRS para su utilización en neonatos.
La estrategia de vacunas con virus muertos o inactivados ya ha sido abandonada.
Las de virus vivos atenuados son altamente inmunógenas, pero presentan los problemas de su escasa estabilidad, su uso poco seguro en neonatos y que la respuesta inmune puede ser inhibida por la presencia de anticuerpos maternos preexistentes transferidos por la placenta.
Las vacunas vivas atenuadas mediante biotecnología utilizando VRS mutantes (cpts530/1009, cpts248/955 y cpts248/404) cosecharon bastantes fracasos y algunas no llegaron a fase III. Producían excesiva congestión nasal en lactantes, lo que invalidaba su uso.
La inmunización basada en la ingeniería genética constituye la única herramienta con el potencial para producir inmunogenicidad en forma segura. Las vacunas de ADN promueven tanto inmunidad celular como humoral y tienen mayor potencial para brindar una protección más completa frente a la infección por el VRS.
En un estudio publicado en 200521, Vaughan et al. probaron una vacuna de ADN contra el VRS en monos rhesus lactantes para evaluar su seguridad, inmunogenicidad y eficacia protectora. Las hipótesis del ensayo fueron que un plásmido de ADN que codifica dos inmunógenos clave del VRS bovino (VSRB), la proteína de fusión (F) y la nucleoproteína (N), sería capaz de producir respuestas inmunes celulares y humorales y brindar protección contra el VRS, y que la vacunación con genes altamente homólogos pero no idénticos de VSRB evitaría la neutralización por anticuerpos maternos preexistentes contra el VRS humano. Aunque niveles moderados de anticuerpos preexistentes sí afectaron a la respuesta humoral, no evitaron la inducción de IgG específica después de la exposición posterior al VRS. Además, la presencia de estos anticuerpos preexistentes no afectó a la inmunidad celular. Estos datos avalan la posible utilidad de este tipo de vacuna en neonatos.
Por otro lado, las vacunas de subunidades, con glucoproteínas F, G y M o partes de las mismas, podrían ser útiles en ancianos, niños seropositivos para el VRS con factores de riesgo y embarazadas, pero no son seguras en niños sin contacto previo con el virus, en quienes podrían producir un efecto potenciador de la enfermedad.
Recientemente, una nueva vacuna contra la proteína de fusión F ha sido elegida para iniciar estudios preclínicos. Los investigadores diseñaron unas partículas virus-like que contenían la proteína F con la configuración exacta en la que existe en la superficie del virus nativo y demostraron protección frente al VRS en ratas, tanto con adyuvante alumínico como sin él22.
Por último, las vacunas de plásmidos de ADN podrían resultar más estables y ser capaces de inducir respuesta humoral y celular. Se ensaya una para aplicación intranasal con nueve antígenos del VRS incluidos en nanopartículas biodegradables.
STREPTOCOCCUS PNEUMONIAE
El neumococo es un diplococo encapsulado grampositivo del que se han identificado unos 90 serotipos en base a las diferencias de composición en la estructura de su cápsula polisacárida. La mayoría de las infecciones en niños se asocian a una veintena de serotipos que varía con el tiempo y la zona geográfica. Menos de una docena de ellos causan el 75% de las enfermedades invasivas graves en cualquier parte del mundo: sepsis, meningitis y neumonías bacteriémicas. El neumococo es el principal patógeno involucrado en las complicaciones asociadas a la gripe. Se estima que causa más de la tercera parte de los dos millones de muertes anuales en niños atribuibles a complicaciones de infecciones respiratorias en el mundo, especialmente en países en desarrollo. Tanto las neumonías bacteriémicas como las sepsis y las menisngitis presentan unas altas tasas de mortalidad. Además, más de un 70% de las meningitis neumocócicas no mortales dejan secuelas permanentes, principalmente neurológicas.
La transmisión se produce por contagio directo con las secreciones respiratorias de los enfermos y los portadores sanos. Aunque la durabilidad del estado de portador es limitada, en época invernal más del 90% de los niños habrán sido portadores en la nasofaringe en algún momento. La tremenda dificultad de control que entraña la vía de transmisión respiratoria, junto con el acuciante problema del incremento de las resistencias bacterianas a penicilinas, cefalosporinas y macrólidos, hace más relevante el papel de las vacunas.
Superada la etapa de las vacunas polisacarídicas con el importante paso de las actuales vacunas conjugadas deca- y tridecavalentes, se sigue investigando en busca de otro tipo de vacuna que pudiera ser universal, válida para todos los serotipos de neumococo. Estas vacunas se basarían en proteínas de la superficie de la membrana del neumococo (PspA, PsaA, PspC y neuraminidasa), proteínas de la pared (autolisina) o proteínas extracelulares (pneumolisina). En este sentido, se han abierto grandes esperanzas en la línea de investigación iniciada en 2008 por la doctora Wei Kong et al., de la Universidad Estatal de Oregón. Desarrollaron una vacuna bacteriana viva utilizando una Salmonella enterica serovariedad Typhimurium modificada genéticamente. Esta Salmonella modificada coloniza el tejido linfático del huésped y fabrica una proteína propia del Streptococcus pneumoniae altamente antigénica: la PspA. Esta proteína se encuentra en la superficie de la membrana del neumococo y, entre otras funciones, inhibe la activación del complemento y la acción de la lactoferrina. Además, la S. enterica utilizada en la vacuna está genéticamente programada para su autodestrucción después de la producción de antígenos, para prevenir así su difusión por el medio ambiente y evitar la posible transferencia de sus genes a otras especies23. Posteriormente, se han seguido estudios en esta línea utilizando además la PspC con el mismo tipo de salmonela. Otros investigadores han desarrollado un neumococo mutante Rx1AL(-)PdT que expresa un pneumolisolide en lugar de pneumolisina y diversos ensayos más con el resto de las proteínas de superficie. En la actualidad hay varias vacunas candidatas estudiándose en modelos animales24.
TOSFERINA
Bordetella pertussis es un cocobacilo gramnegativo inmóvil, patógeno humano obligado, que se presenta solo en parejas y exige medios especiales para su cultivo. Produce factores biológicamente activos, responsables de los signos y síntomas de la enfermedad, cuya capacidad inmunogénica es la base de las vacunas acelulares: toxina pertussis, hemaglutinina filamentosa, adenilciclasa, citotoxina traqueal, aglutinógeno fimbrial, toxina dermonecrótica y pertactinas. La toxina pertussis es la que causa la enfermedad de la tosferina, pues la bacteria no penetra más allá del epitelio en el organismo. Además, la Bordetella posee una endotoxina que probablemente sea la responsable de la fiebre. Dada la importante carga de enfermedad que produce la tosferina, especialmente en países en vías de desarrollo y centrada en los lactantes más pequeños, se siguen buscando estrategias para mejorar la eficacia de su vacunación. Una de ellas es añadir a vacuna tosferina la pertactina-2 además de la 1 para generar mayor inmunogenicidad, pues se ha visto que se está produciendo un recambio de serotipos de Bordetella pertussis con mayor expresión de la tipo 2 que la 1. Conseguir mayores títulos de anticuerpos frente a la pertactina-2 mejoraría la protección.
Por otro lado, se estudia la posibilidad de adelantar la inmunización al nacimiento y al mes de vida, para proteger a los más vulnerables. Un reciente estudio piloto señala resultados prometedores en esta línea25 aunque deben ser confirmados por un ensayo clínico que solvente sus limitaciones metodológicas: determinar si la seroconversión obtenida es clínicamente protectora y si la pauta de administración interfiere con la seroconversión frente a otros antígenos vacunales.
Tampoco se abandona la idea de vacunar a los jóvenes y adultos con bajas dosis para que, protegiéndose ellos de una enfermedad leve, protejan a su vez a los lactantes en los que presenta mayor gravedad.
OTRAS
Durante los últimos años se han seguido produciendo avances en otras muchas áreas del campo de la Vacunología. Se sigue investigando en nuevas vacunas contra la gripe, tanto inactivadas como vivas atenuadas, que son las usadas actualmente como otras más novedosas de subunidaes formuladas en virosomas: las espículas de superficie de tres cepas gripales habitualmente circulantes se insertan en otras tantas vesículas de membrana de virosomas. Una vacuna intranasal de estas características hubo de ser retirada por problemas neurológicos (parálisis de Bell), pero se sigue investigando en esta línea. También se han probado vacunas intraepidérmicas de ADN del virus de la gripe que de momento solo han mostrado buenos resultados cuando los individuos vacunados ya poseían anticuerpos previos a la vacunación, elevando las titulaciones previas. Por último se han desarrollado vacunas por ingeniería genética fusionando la proteína M2 del virus de la gripe con el core del virus de la hepatitis B o con el complejo de proteínas de la membrana externa (OMPC) del meningococo.
Se investiga para obtener una vacuna frente al coronavirus causante del SARS (severe acute respiratory syndrome, que apareció en China en el 2002): actualmente hay media docena de líneas de investigación abiertas.
Siguen en marcha proyectos para la obtención de vacunas frente a bacterias tales como Staphylococcus aureus, Streptococcus del grupo B, Escherichia coli, Shigella y Moraxella catarrhalis entre otras, así como frente a virus: Parainfluenza, herpes zóster, herpes tipo 2, citomegalovirus y los flavivirus causantes del dengue, la fiebre amarilla, la encefalitis centroeuropea y la japonesa. Por último, se investiga también en busca de una vacuna frente a la amebiasis, aunque las vacunas antiparasitarias siempre son mucho más complejas como ya reseñamos anteriormente al referirnos a la malaria.
LECTURAS RECOMENDADAS
-
Bassat Q, Alonso P. Paludismo. En: Manual de vacunas en Pediatría 2008, 4.ª ed. Comité Asesor de Vacunas de la AEP; 2008. p. 710-22.
Situación y perspectivas en la investigación de vacunas frente a la malaria. -
Esteban Rodríguez M. Desarrollo de vacunas contra el VIH/SIDA. Anal Real Acad Nac Farm. 2007;73:1047-78.
Estado de la cuestión y líneas de investigación en vacunas frente al SIDA. -
Girard MP, Cherian T, Pervikov Y, Kieny MP. A review of vaccine research and development: Human acute respiratory infections. Vaccine. 2005;23:5708-24.
Amplia revisión bien estructurada del estado de la cuestión en lo referente a vacunas frente a patógenos respiratorios. -
González Romo F. Virus respiratorio sincitial. En: Manual de vacunas en Pediatría 2008, 4.ª ed. Comité Asesor de Vacuna de la AEP; 2008 p. 746-54.
En estos capítulos se abordan el estado de las investigaciones y las perspectivas futuras sobre la vacunación frente a VIH, VRS y otras novedades. - Picazo JJ, González Romo F. VIH. En: Manual de vacunas en pediatría 2008, 4.ª ed. Comité Asesor de Vacuna de la AEP; 2008. p. 723-45.
- Picazo JJ, González Romo F. Futuro en el desarrollo de las vacunas. En: Manual de vacunas en Pediatría 2008, 4.ª ed. Comité Asesor de Vacunas de la AEP; 2008. p. 772-85.
BIBLIOGRAFÍA
- Yuki Y, Kimono H. Mucosal vaccines: novel advances in technology and delivery. Expert Review of Vaccines. 2009;8:1083-97 [en línea]. Disponible en: http://www.expert-reviews.com/doi/abs/10.1586/erv.09.61
- Sadarangani M, Pollard AJ. Serogroup B meningococcal vaccines-an unfinished story. Lancet Infect Dis. 2010;10:112-24.
- Food and Drug Administration. Neisseria Meningittidis serogroup B vaccine. Vaccine and Related Biological Products Advisory Committee. Pre-Meeting Background Document, 4 March 2011 [en línea]. Disponible en: http://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/BloodVaccinesandOtherBiologics/VaccinesandRelatedBiologicalProductsAdvisoryCommittee/UCM249479.pdf
- Richmond PC, Marshall HS, Nissen MD, Jiang Q, Jansen KU, Garcés-Sánchez M, et al. Safety, immunogenicity, and tolerability of meningococcal serogroup B bivalent recombinant lipoprotein 2086 vaccine in healthy adolescents: a randomised, single-blind, placebo-controlled, phase 2 trial. Lancet Infect Dis. 2012;12(8):597-607.
- Santolaya ME, O’Ryan ML, Valenzuela MT. Immunogenicity and tolerability of a multicomponent meningococcal serogroup B (4CMenB) vaccine in healthy adolescents in Chile: a phase 2b/3 randomised, observer-blind, placebo-controlled study. Lancet. 2012;18(379):617-24.
- Girarda MP, Reedb ZH, Friedeb M, Paule Kienyb MP. A review of human vaccine research and development: Malaria. Vaccine. 2007;25:1567-80.
- Hoffman SL, Goh LML, Luke TC. Protection of Humans against Malaria by Immunization with Radiation-Attenuated Plasmodium falciparum Sporozoites. J Infect Dis. 2002;185:1155-64.
- Richie TL, Saul A. Progress and challenges for malaria vaccines. Nature. 2002:415;694-701 [en línea]. Disponible en: http://www.doh.gov.za/issues/malaria/red_reference/case_management/cm8.pdf
- Sacarlal J, Aide P, Aponte JJ. Long-term safety and efficacy of the RTS,S/AS02A malaria vaccine in Mozambican children. J Infect Dis. 2009;200:329-36
- Wilby KJ, Lau T, Gilchrist SE, Ensom M. Mosquirix (RTS,S): A Novel Vaccine for the Prevention of Plasmodium falciparum Malaria. Ann Pharmacother 2012;46:384-93.
- Agnandji ST, Asante KP, Lyimo J, Vekemans J, Soulanoudjingar SS, Owusu R, et al. Evaluation of the safety and immunogenicity of the RTS,S/AS01E malaria candidate vaccine when integrated in the expanded program of immunization. J Infect Dis. 2010;202:1076-87.
- Gómez CE, Nájera JL, Pérez Jiménez E, Jiménez V. Head-to-head comparison on the immunogenicity of two HIV/AIDS vaccine candidates based on the attenuated poxvirus strains MVA and NYVAC co-expressing in a single locus the HIV-1BX08 gp120 and HIV-1IIIB Gag-Pol-Nef proteins of clade B. Vaccine. 2007;25:2863-85.
- Rerks-Ngarm S, Pitisuttithum P, Nitayaphan S. Vaccination with ALVAC and AIDSVAX to prevent HIV-1 infection in Thailand. N Engl J Med. 2009;361:2209-20.
- Kauffman SHE. Rational vaccine development against tuberculosis: Those who don’t remember the past are condemned to repeat it. Microbes and Infection. 2005;7:897-8.
- Brewer TF. Preventing Tuberculosis with Bacillus Calmette-Guerin Vaccine: A Meta-Analysis of the Literature. Clin Infect Dis. 2000;31(Suppl 3):S64-7.
- Ly LH, McMurray DN. Tuberculosis: vaccines in the pipeline. Expert Rev Vaccines. 2008;7:635-50.
- Hoft D. Tuberculosis vaccine development: goals, immunological design, and evaluation. Lancet. 2008;372:164-75.
- Kauffmann SHE. Is the development of a new tuberculosis vaccine possible? Nature Medicine. 2000;6:955-60 [en línea]. Disponible en: http://cmbi.bjmu.edu.cn/cmbidata/proteome/apply/pdf/03.pdf
- Mizuuchi K. A new look at tuberculosis vaccination. PNAS. 2007;104:122.
- Gonzalo-Asensio J, Mostowy S, Harders-Westerveen J. PhoP: a missing piece in the intricate puzzle of Mycobacterium tuberculosis virulence. PLoS ONE. 2008;3:e3496.
- Vaughan K, Rhodes GH, Gershwin LJ. DNA Immunization against Respiratory Syncytial Virus (RSV) in Infant Rhesus Monkeys. Vaccine. 2005.23(22):2928-42.
- Novavax announces selection of a respiratory syncytial virus vaccine candidate for advanced preclinical studies [en línea]. Disponible en: www.novavax.com/download/releases/RSV%20fo.pdf
- Kong W, Wanda S, Zhang X. Regulated programmed lysis of recombinant Salmonella in host tissues to release protective antigens and confer biological containment. PNAS. 2008;105:9131-2 [en línea]. Disponible en: http://www.pnas.org/content/105/27/9131.full.pdf+html
- Ogunniyi1 AD, Grabowicz1 M, rileBs DE, Cook1 J, Paton JC. Development of a Vaccine against Invasive Pneumococcal Disease Based on Combinations of Virulence Proteins of Streptococcus pneumoniae. Infect Immun. 2007;75:350-7.
- Wood N, McIntyre P, Marshall H, Roberton D. Acellular pertussis vaccine at birth and one month induces antibody responses by two months of age. Pediatr Infect Dis J. 2010;29:209-15.