Insuficiencia renal aguda
2 Hospital Universitario Fundación Alcorcón. Alcorcón. Madrid (España).
RESUMEN
La insuficiencia renal aguda (IRA) se caracteriza por la disminución brusca del filtrado glomerular con retención de productos nitrogenados derivados del catabolismo proteico y la incapacidad para mantener la homeostasis de líquidos, electrolitos y del equilibrio ácido-base. Dependiendo del mecanismo fisiopatológico, la IRA puede ser prerrenal, caracterizada por mecanismos de compensación para mantener el flujo renal ante una disminución del filtrado glomerular; renal, caracterizada por el daño provocado por la hipoxia o toxicidad directa, y posrrenal, generada por la retrodifusión tubular. Los datos clínicos y analíticos y la historia clínica permiten la mayoría de las ocasiones el diagnóstico diferencial entre ellas. El dato clínico principal es la alteración de la diuresis, clasificando la IRA de acuerdo a la misma, en oligoanúrica, poliúrica o con diuresis conservada. Otros síntomas que sugieren IRA son edema, hipertensión, hematuria macroscópica y alteración en el sedimento urinario.
El diagnóstico se realiza mediante comprobación del deterioro de la función renal por el ascenso de la creatinina plasmática. La bioquímica urinaria será un dato fundamental para orientar la fisiopatología y consecuentemente el manejo del paciente. La prueba de imagen que más aporta al diagnóstico es la ecografía renal.
El pronóstico depende más de la causa desencadenante que de la IRA, que en general es favorable. La prevención en los pacientes de riesgo consiste en evitar fármacos neurotóxicos y situaciones de hipovolemia. Inicialmente se intentará un manejo conservado, y si estas medidas no son suficientes, se comenzará con técnicas de depuración extrarrenal, siendo de elección en los niños la diálisis peritoneal y la hemofiltración en sus distintas modalidades.
PUNTOS CLAVE
- La IRA es un síndrome clínico caracterizado por la disminución brusca del filtrado glomerular.
- La IRA es un motivo de consulta poco frecuente en el medio extrahospitalario pero conlleva una morbimortalidad elevada.
- La mortalidad de la IRA depende de la causa desencadenante y de la edad del niño. La IRA con etiología exclusiva nefrológica tiene buen pronóstico.
- La IRA prerrenal se debe a un deterioro repentino de la perfusión renal por disminución súbita del volumen intravascular.
- En la IRA renal o parenquimatosa, la lesión isquémica derivada de hipoxia o tóxicos puede causar disfunción celular con degradación y necrosis celular.
- La IRA posrenal se debe a una obstrucción a la salida de la orina.
- La prevención en los pacientes de riesgo evita la IRA.
- Las técnicas de depuración extrarrenal se instauran cuando han fracasado las medidas conservadores.
EL PROBLEMA EN NUESTRO MEDIO
La insuficiencia renal aguda (IRA) es un síndrome clínico caracterizado por la disminución brusca del filtrado glomerular con retención de productos nitrogenados derivados del catabolismo proteico con incapacidad para mantener la homeostasis de líquidos, electrolitos y del equilibrio ácido-base. En fases iniciales es muy poco expresivo, el principal dato analítico con el que se manifiesta es la elevación de la urea y de la creatinina por encima de dos desviaciones estándar del valor normal para cada edad, no siendo constante la disminución de la diuresis1,2.
Debemos diferenciar entre IRA, aquella que se instaura de forma brusca, e insuficiencia renal crónica (IRC), deterioro progresivo del filtrado glomerular, con agudización. Ambas entidades son poco frecuentes en el medio extrahospitalario y no hay datos exactos de su incidencia y prevalencia. La incidencia de la IRA es aproximadamente del 1% de los ingresos, dato que varía según las series. Se considera que del 3 al 10% de las hospitalizaciones en Unidades de Cuidados Intensivos Pediátricos son por IRA, y un porcentaje elevado de los pacientes ingresados sufrirán IRA durante su ingreso. La mortalidad de la IRA depende de la causa desencadenante y de la edad del niño, siendo peor el pronóstico en el periodo neonatal. Podría afirmarse que en la mayoría de los casos los pacientes fallecen con IRA pero no por IRA. La IRA infantil suele ser reversible, pero una pequeña proporción progresa a IRC. La IRA con etiología exclusiva nefrológica tiene buen pronóstico.
Las tres causas principales de IRA en niños en países en vías de desarrollo son el síndrome hemolítico urémico (31%), la glomerulonefritis (23%) y la sepsis/isquemia prerrenal posoperatoria (18%), a diferencia de los países industrializados, en los que las tres causas más frecuentes son enfermedad renal intrínseca (44%), shock séptico posoperatorio (34%) y trasplante de órgano/medula ósea (13%)3.
La IRC, aunque no afecte a un número elevado de niños, es un problema de salud importante que conlleva una elevada morbimortalidad y un consumo elevado de recurso sanitarios. Estos pacientes son más susceptibles a un deterioro agudo de la función renal. Los datos epidemiológicos más fiables proceden de los registros de casos en una población bien definida. En España, la Sociedad Española de Nefrología Pediátrica (REPIR) inició el registro de niños con edad inferior a 15 años con insuficiencia renal terminal en 1968, el número aproximado de pacientes es de unos 600. En 2009 se comenzó el registro de los niños con insuficiencia renal preterminal REPIR II, que incluye actualmente unos 1500 niños. La causa más frecuente de IRC en España es la hipoplasia/displasia con uropatía o sin ella; en segundo lugar están las enfermedades hereditarias seguidas de glomerulopatías primarias y enfermedades sistémicas4. Tanto la IRA como la IRC son motivo de consulta raro en Atención Primaria y casi siempre esta indicada la derivación del paciente al medio hospitalario. En general, surgirá al detectar una elevación de la urea y la creatinina en una analítica realizada de forma rutinaria o por sospecha clínica de enfermedad renal ante alteraciones de la diuresis en el ritmo (oliguria, poliuria), en las características macro- o microscópica (hematuria, proteinuria). Otros datos de la exploración que nos pueden hacer sospechar insuficiencia renal serán la presencia de hipertensión arterial (HTA), edemas o retraso en el crecimiento.
Aunque es raro que un paciente con IRA se maneje de entrada en Atención Primaria, o que sea remitido para seguimiento, sí es posible que consulte cuando se le ha dado el alta del ingreso hospitalario entre las revisiones en consultas externas del hospital, por procesos intercurrentes como cuadros catarrales, fiebre, vómitos, diarreas, etc. Lo mismo puede suceder con los pacientes afectos de IRC. Por ese motivo, es importante que estemos familiarizados con las posibles complicaciones de su patología de base.
ENFOQUE DIAGNÓSTICO
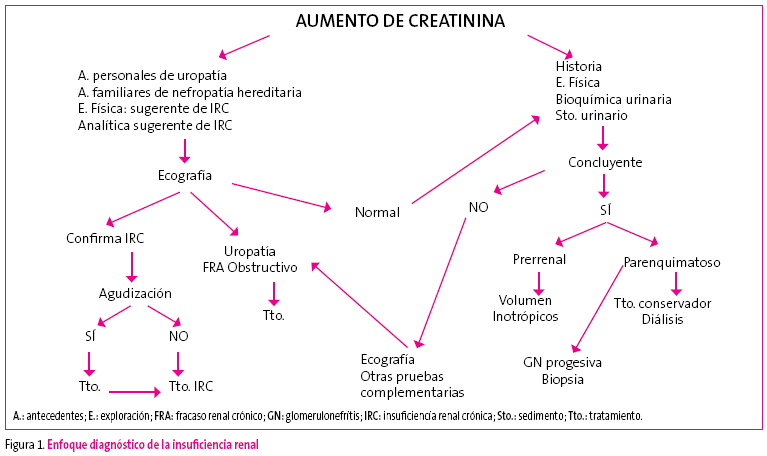
El enfoque diagnóstico no difiere en los pasos iniciales de los demás síndromes clínicos (Figura 1).
Figura 1. Mostrar/ocultar
Se inicia con una historia clínica que incluye anamnesis y exploración física, pasando a valorar posteriormente las exploraciones complementarias, entre las que destacan la bioquímica y el sedimento urinario.
El primer objetivo de la historia clínica es determinar si nos encontramos ante un IRA o ante una IRC; para ello, indagaremos sobre la presencia de poliuria o polidipsia, infecciones urinarias de repetición y los antecedentes familiares de enfermedades renales.
El segundo objetivo será determinar cuál es la etiopatogenia del trastorno, que nos orientará hacia una etiología y, lo que es más importante, hacia una actitud terapéutica: historia de diarrea, vómitos, cuadro febril, ingesta de medicamentos, accidentes, e intervención quirúrgica nos orientarán hacia una patogenia prerrenal, posibles alteraciones en el aspecto y la cantidad de orina pueden sugerir una patogenia parenquimatosa y hematuria macroscópica con dolor cólico puede sugerir patogenia obstructiva o posrenal2.
La presencia en la exploración física de los siguientes datos sugiere enfermedad renal: retraso de peso y talla sugestivo de IRC, HTA, presencia de edemas, masas y soplos abdominales y alteraciones óseas sugestivas de raquitismo.
Pruebas de laboratorio
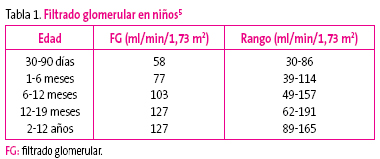
La bioquímica sanguínea muestra un aumento de urea y creatinina cuando el filtrado glomerular desciende un 5%. El principal problema es determinar cuáles son los valores normales de creatinina en niños, pues en la infancia los valores de creatinina, más que los de urea, varían fisiológicamente con la edad, al igual que el filtrado glomerular (Tabla 1).
Tabla1. Mostrar/ocultar
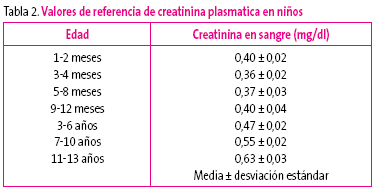
La creatinina depende de la función renal, pero también de la masa muscular y del catabolismo proteico, que se modifican con la edad (Tabla 2).
Tabla 2. Mostrar/ocultar
Podríamos considerar una IRA cuando la creatinina sérica es igual o superior al doble del valor normal para la edad del enfermo y siempre si es superior a 1 mg/dl (Tabla 2)6.
La clasificación RIFLE según la Acute Diálisis Quality Initiative (ADQI)7 estratifica los estadios de la IRA de acuerdo a la elevación de la creatinina:
- Riesgo (Risk): creatinina plasmática = creatinina basal x 1,5.
- Lesión (Injury): creatinina plasmática = creatinina basal x 2.
- Fracaso (Failure): creatinina plasmática = creatinina basal x 3 o mayor de 4 mg/dl.
- Pérdida (Loss): fracaso renal persistente más de cuatro semanas.
- Fracaso renal terminal (End stage kiney disease): pérdida de función por un tiempo superior a tres meses.
Las cifras de urea pueden encontrarse desproporcionadamente elevadas respecto a las de creatinina en la IRA poliúrica o con diuresis conservada, debido al aumento del catabolismo. Encontraremos alteraciones electrolíticas: hiponatremia por acúmulo de líquidos libres de soluto; hiperpotasemia por la incapacidad de eliminar el potasio que aporta la dieta, el procedente de la situación catabólica, la degradación de tejidos necróticos, la hemólisis de los hematíes y la acidosis; hipocalcemia por la acidosis e hiperfosforemia; hipermagnesemia moderada y acidosis metabólica por incapacidad para excretar hidrogeniones y generar bicarbonato endógenamente.
El hemograma, en el que el hallazgo más frecuente es una anemia normocítica y normocrómica moderada. La anemia grave con reticulocitosis, anisocitosis, hematíes fragmentados y células en yelmo, acompañada de una trombopenia, es diagnóstica del síndrome hemolítico-urémico. Puede ayudar a diferenciar la IRC, ya que la anemia es grave, no existe trombopenia y la extensión periférica es normal. La leucocitosis puede estar presente en el síndrome hemolítico-urémico, en la deshidratación y asociada a situaciones de estrés. pero también puede indicar infección.
El estudio de coagulación no suele estar alterado, aunque la funcionalidad de las plaquetas puede estar alterada por la uremia.
El sedimento urinario: células, cilindros y cristales. La valoración citológica urinaria no solo es fundamental para el diagnóstico etiológico, sino que también puede predecir la gravedad y el pronóstico8.
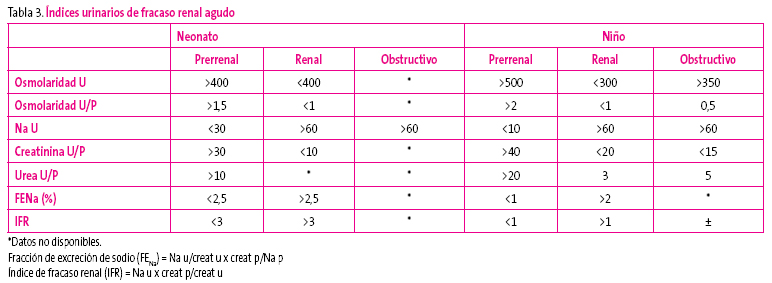
La importancia de la bioquímica urinaria radica en que refleja la influencia de la noradrenalina, la angiotensina II, la aldosterona y la vasopresina, mediante la determinación del sodio, la creatinina, la urea y la osmolalidad urinaria. Si dicha influencia esta ausente, indica un daño estructural en el parénquima renal. Se realiza una valoración absoluta de los datos urinarios y la relación con la bioquímica sanguínea (Tabla 3).
Tabla 3. Mostrar/ocultar
El índice de fracaso renal es, en la actualidad, el índice más válido para determinar el tipo de fracaso renal agudo. La limitación principal es que en muchos de estos pacientes se han utilizado previamente diuréticos. La IRA prerrenal se debe sospechar en el paciente con elevación de la creatinina, con una historia reciente de hipovolemia verdadera o disminución del volumen circulante efectivo. Nos encontramos una densidad urinaria mayor de 1018, una osmolalidad mayor de 500 mOsm/l, sodio urinario menor de 10, con una fracción de excreción de sodio menor del 1%, detectando un sedimento normal o con presencia de cilindros hialinos. Si existe una fuerte sospecha clínica, está indicado hacer una prueba de sobrecarga de volumen. Esto puede ser suficiente para que se inicie la diuresis. Los hallazgos típicos de la IRA parenquimatosa incluyen un sedimento con cilindros granulosos, con frecuencia pigmentados, cilindros de células epiteliales tubulares, detritus celulares. La orina es isosmótica con el plasma, con una osmolalidad aproximada de 300 mOsm/l, densidad menor de 1010, sodio mayor de 20 y fracción de excreción de sodio mayor de 1. En este caso, la prueba de expansión está contraindicada. Existe un síndrome intermedio en el que se ha iniciado una necrosis tubular aguda pero que no ha llegado a establecerse. Estos pacientes presentan una isquemia no oligúrica o nefrotóxica. En el sedimento se objetivan cilindros epiteliales o celulares, pero en la orina el sodio y la fracción de excreción de mismo están bajos. Tienen una respuesta parcial a los cambios de volumen. Se caracteriza por una fase de mantenimiento muy corta y un pronóstico mejor9.
La disminución de la diuresis suele ser lo más frecuente pero no siempre sucede así, por lo tanto clasificaremos la IRA en: anúrica u oligúrica cuando presenta una diuresis menor de 0,8 ml/kg/hora en niños mayores de un año, o menor de 500 ml/día/1,73 m2; la IRA poliúrica cursa con diuresis mayor de 1 l/día/m2, aparece en un tercio de los fracasos renales agudos de la infancia y con diuresis conservada cuando se mantiene en rango normal.
Se debe realizar un estudio microbiológico en función de la sintomatología del paciente. La infección puede ser una causa y una complicación de la IRA. Los estudios inmunológicos están indicados en los pacientes en los que exista sospecha de glomerulonefritis por un sedimento, o clínica compatible. La glomerulonefritis aguda posinfecciosa es la más frecuente en la edad pediátrica. El cuadro más grave, aunque menos frecuente en la infancia, es la glomerulonefritis rápidamente progresiva, que puede ser idiopática o sobreañadida a una glomerulonefritis primaria como la mesangiocapilar (sobre todo la tipo II), la membranosa o la nefropatía IgA. Para el diagnóstico diferencial son de ayuda C3, C4, anticuerpos antinucleares, anticuerpos citoplasmáticos antineutrófilos, factor nefrítico C3, crioglobulinas, inmunocomplejos circulantes, anticuerpos antimembrana basal glomerular, anticuerpos antiestreptolisina O y antidnasa B10.
Las pruebas de imagen radiológicas se deben iniciar con la ecografía siempre que sospechemos una malformación congénita, IRC o no existan datos orientativos de una etiología prerrenal. Diagnostica la IRA obstructiva, permite diagnosticar hidronefrosis, displasias, agenesias y poliquistosis. Determina el tamaño renal: si los riñones están disminuidos, ello es muy orientativo de IRC (aunque este dato no descarta una IRA sobreañadida); si están aumentados y son hiperecogénicos, el cuadro es compatible con IRA parenquimatosa. Algunos autores correlacionan la disminución del tamaño renal con la disminución de la creatinina y la recuperación de la IRA11,12. La ecografía Doppler permite, mediante los datos de flujo renal y resistencias vasculares, diferenciar la IRA prerrenal de la parenquimatosa13. La radiografía simple de tórax nos aporta datos sobre las complicaciones y tiempo de evolución de la IRA (edema agudo de pulmón, insuficiencia cardiaca) y sobre la etiología (cardiopatía congénita). Si existe IRC, los datos de osteodistrofia renal serán evidentes14. La pielografía retrógrada y anterógrada se utiliza para el diagnóstico del punto de obstrucción, en ocasiones puede ser terapéutica. La urografía intravenosa y la tomografía axial computarizada están contraindicadas. La resonancia magnética nuclear da una información anatómica precisa. La angiografía puede ser diagnóstica y terapéutica ante la sospecha de trombosis de arteria renal.
Las pruebas de imagen mediante isótopos incluyen el renograma diurético utilizando MAG-3 marcado con tecnecio (Tc) 99m (técnica de elección) que, gracias a sus tres fases (vascular, parenquimatosa y de eliminación), permite diagnosticar la presencia de un problema vascular (trombosis de la arteria renal), una alteración parenquimatosa (necrosis tubular aguda) y una obstrucción en la vía urinaria (congénita o adquirida). En muchas ocasiones permite diferenciar la IRA aguda de la crónica (en la IRC sus tres fases están alteradas). La gammagrafía renal con DMSA marcado con Tc 99m es útil para diagnosticar cicatrices renales que pueden ser causa de IRC15. La anatomía patológica es diagnóstica en muchos casos. La biopsia renal está indicada en la IRA en los siguientes casos: sospecha de glomerulonefritis rápidamente progresiva, IRA sin causa aparente, sospecha de nefritis intersticial aguda sin datos clínicos evidentes, IRA con más de seis semanas de evolución, si no se inicia recuperación, y posibilidad de insuficiencia renal crónica de causa no filiada anterior a la IRA. No se debe realizar en los casos en que se sospecha una necrosis tubular aguda con causa aparente, ni en el síndrome hemolítico-urémico o la púrpura trombótica trombocitopénica con evidencia clínica suficiente16.
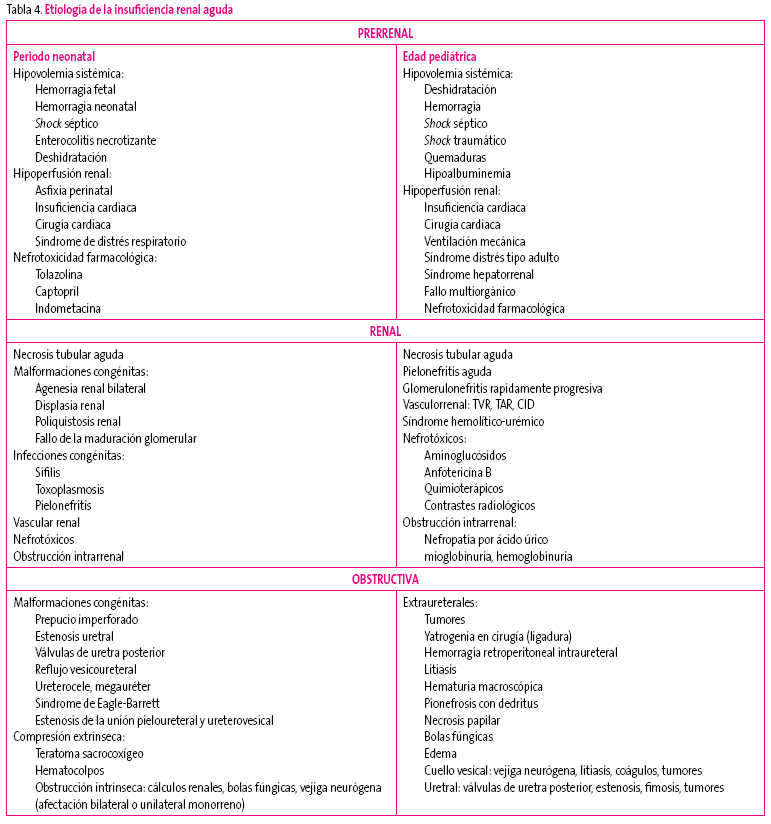
La conjunción de todos estos datos nos llevará al diagnóstico etiológico (Tabla 4).
Tabla 4. Mostrar/ocultar
Las medidas preventivas, el manejo conservador y las técnicas dialíticas pretenden mantener al paciente hasta que se instaura el tratamiento etiológico y se consigue la curación, si es posible.
MEDIDAS PREVENTIVAS
Debido a la morbimortalidad asociada a la IRA, es importante que los pediatras de Atención Primaria identifiquen a los pacientes que tienen riesgo elevado de padecer una IRA. Algunas estrategias son evitar fármacos neurotóxicos, realizar un aporte correcto de líquidos en pacientes con IRC con uropatías que son susceptibles de deshidrataciones e IRA de etiología prerrenal. En la necrosis tubular aguda, de etiología prerrenal, se ha propuesto el uso del manitol en dosis de 1 g/kg, con objeto de acortar su curso; sin embargo, en presencia de oliguria, puede empeorar la hiponatremia, al expandir el volumen extracelular, y no es aconsejable. La furosemida se puede utilizar precozmente con objeto de convertir la IRA en poliúrica, que va a permitir un mejor manejo de los líquidos y puede evitar las técnicas dialíticas. Si existe respuesta, el uso de una perfusión continua mantiene la diuresis y tiene menos efectos secundarios; si no existe respuesta al bolo inicial (megadosis de 6 mg/kg/dosis), se debe suspender para evitar efectos secundarios. La dopamina, en dosis dopaminérgicas, en pacientes con flujo comprometido tiene probada eficacia. Todas estas medidas, una vez instaurado el fracaso renal intrínseco, son de poca utilidad17,18.
MANEJO CONSERVADOR
El manejo conservador de la IRA se debe instaurar en el momento en que se sospecha. Consiste en adecuación de la fluidoterapia, aporte de iones, tratamiento conservador y de emergencia de los trastornos electrolíticos, control de la tensión arterial (TA) y aporte calórico correcto. Fluidoterapia: se debe aportar una cantidad igual a las pérdidas insensibles 400 cc/m2 de superficie corporal, más la diuresis (en el fracaso poliúrico 2/3 del exceso) y las pérdidas extrarrenales. El aporte de iones será igual a las pérdidas por orina y líquidos corporales19.
En cuanto al tratamiento de las alteraciones hidroelectrolíticas:
- Hiponatremia: restricción hídrica, solo cuando es grave y sintomática, con clínica neurológica, se administrará cloruro sódico al 3% en 2-4 horas hasta remitir la sintomatología elevando la natremia solo a cifras de seguridad.
-
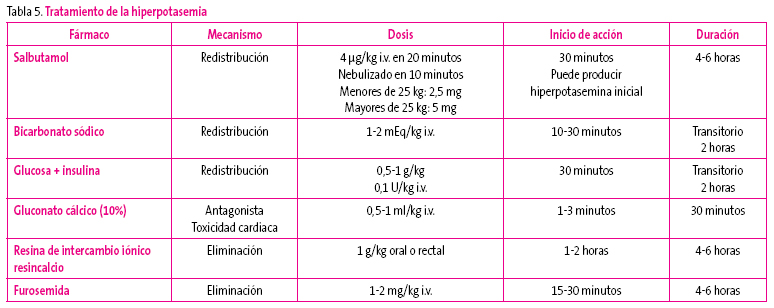
Hiperpotasemia: es una complicación que puede poner en peligro la vida del paciente, se inicia cuando el potasio supera 6 mEq/l o tiene repercusión sobre el electrocardiograma (Tabla 5).
Tabla 5. Mostrar/ocultar - Acidosis: se corregirá solo si es grave, con pH inferior a 7,2 o bicarbonato inferior a 14, se administra bicarbonato sódico lentamente, en 12-24 horas, para conseguir un bicarbonato de 18 mEq/l.
- Hipocalcemia-hiperfosforemia:se restringirá el aporte de fósforo, se utilizarán quelantes (carbonato cálcico) y en la hipocalcemia grave o sintomática gluconato cálcico al 10% (1 ml/kg diluido al 50% con suero glucosado al 5%, a pasar en 15-30 minutos).
La HTA se debe a sobrecarga de volumen fundamentalmente. El tratamiento de elección son los diuréticos y, dentro de este grupo, la furosemida, que actúa con un aclaramiento de creatinina inferior a 50 ml/min/1,73 m2. Si no existe respuesta se utilizarán vasodilatadores, bloqueantes del calcio o inhibidores de la enzima convertidora de la angiotensina. Algunas glomerulonefritis y el síndrome hemolítico-urémico pueden cursar con crisis hipertensivas, en ese caso, otras opciones de tratamiento son labetalol y nitroprusiato sódico. En neonatos, el tratamiento de elección es la hidralazina asociada a hidroclorotiazida. Los antagonistas del calcio no deben utilizarse en este periodo y el captopril puede inducir hipotensiones que comprometan el flujo renal y cerebral, por lo que debe dejarse como tratamiento de segunda elección20. La nutrición debe ser iniciada lo más precozmente posible y, como es frecuente el vómito, la nutrición enteral a débito continuo, mediante sonda nasogástrica, puede ser suficiente en pacientes no críticos. Si el paciente está crítico se debe iniciar la nutrición parenteral. Se ha demostrado que la malnutrición en los pacientes con pocas reservas y un organismo en crecimiento agrava el pronóstico. Los aportes calóricos basales se calcularán por el peso (no deben ser inferiores a 45-60 kcal/kg) y solo un 8% debe corresponder a proteínas en forma de aminoácidos esenciales con mayor porcentaje de ramificados21-23.
INDICACIONES DE TÉCNICAS DE DEPURACIÓN EXTRARRENAL
El compromiso hemodinámico (edema agudo de pulmón, insuficiencia cardiaca, HTA refractaria a tratamiento médico y asociada a sobrecarga hídrica), las alteraciones electrolíticas graves, sin respuesta a medidas conservadoras de emergencia, la urea igual o superior a 300 mg/dl (cifra con la que aparecen las complicaciones urémicas) y la anuria prolongada son indicaciones absolutas. Un aumento de la urea de 40 mg/dl (no solo como indicador de función renal, sino también de situación catabólica y posibilidad de deterioro global del paciente) o el aumento de la creatinina de 0,5 mg/dl cada 24 horas, la necesidad de iniciar alimentación con el aporte de líquidos que conlleva, o bien la necesidad de expansión de volemia, por situación hemodinámica, son indicaciones electivas. La depuración de derivados proteicos, no determinados en la práctica clínica habitual, que son nocivos en el organismo, y de sustancias inmunomoduladoras en la sepsis, aboga por el inicio precoz de las técnicas de depuración extrarrenal. Sin embargo, la hipoperfusión generada a nivel renal puede prolongar la evolución de la necrosis tubular, por ello, cuando la indicación no es absoluta, hay que valorar la causa que la ha generado y los beneficios que se obtienen con la técnica, sin olvidar las posibles complicaciones que implica24-26.
MODALIDADES DE TÉCNICAS DE DEPURACIÓN EXTRARRENAL
La diálisis peritoneal aguda va a ser la técnica urgente de elección en neonatos, lactantes e incluso niños mayores. Los nuevos catéteres y cicladoras hacen que esté casi exenta de complicaciones. Los líquidos de diálisis, bien de agudos o de crónicos, que existen comercializados en la actualidad, se pueden utilizar en niños mayores de un mes. En los neonatos, debido a la inmadurez hepática que impide la correcta metabolización de lactato a bicarbonato, conviene preparar líquidos con composición similar, pero sustituyendo el lactato por bicarbonato (teniendo presente que la concentración de sodio no debe ser superior a 140 mEq/l), con glucosa al 2% y administrando el calcio intravenoso para evitar la precipitación del mismo27,28. La hemodiálisis aguda es la técnica más rápida y eficaz. Tiene el inconveniente de necesitar un acceso venoso que proporcione un flujo adecuado, cosa complicada en pacientes menores de un año y que se encuentran en una situación hemodinámica inestable, que no va a permitir la ultrafiltración necesaria. Se debe realizar con dializadores de superficie menor a la que se utilizaría en un paciente crónico y hemodinámicamente estable, de la misma superficie corporal, con flujo sanguíneo más bajo. La hemodiálisis secuencial (ultrafiltración no combinada con diálisis) es de elección en los pacientes que requieran una ultrafiltración mayor del 2,5% del peso corporal, teniendo en cuenta que una ultrafiltración de más de un 5% induce hipotensión, precisando administrar suero salino o coloides. La ultrafiltración tiene que ser controlada y exacta en todos los casos. En los niños menores de 10 kg es necesario en el momento de la conexión introducir el volumen de cebado, en niños entre 10-15 kg es aconsejable.
La hemofiltración arteriovenosa continua, basada en la TA media que mueve la sangre a través de un filtro, es la técnica de elección en pacientes hemodinámicamente inestables en los que es necesario un balance negativo de líquidos, consiguiendo una depuración lenta de sustancias de peso molecular medio. Requiere un acceso venoso y otro arterial con buen flujo. En los últimos años, la introducción de bombas de hemofiltración ha permitido realizar variantes de esta técnica con dos accesos venosos (hemofiltración venovenosa) y con tensiones arteriales bajas, lo que ha ampliado las indicaciones, la utilidad y el empleo de la misma, ya que al conseguir mayores flujos aumenta la depuración29. Los líquidos de diálisis en sentido contracorriente a la sangre, añadidos (hemodiafiltración arteriovenosa o venovenosa continua), permiten disponer de una hemodiálisis continua que no provoca alteración hemodinámica y que permite depurar pequeñas y medianas moléculas sin provocar alteraciones hidroelectrolíticas, siendo útil en trastornos metabólicos, sepsis y fracaso renal agudo de cualquier etiología. La combinación de esta técnica con las bombas de circulación extracorpórea ha disminuido la necesidad de ultrafiltración en los pacientes sometidos a cirugía cardiaca30.

BIBLIOGRAFÍA
- Brady HR, Singer GG. Acute renal failure. Lancet. 1995;346:1533-40.
- Andreoli SP. Management of acute renal failure. En: Barratt TM, Avner ED, Harmon WE (eds.). Pediatric Nephrology, 4th ed. Baltimore, USA: Lippincott Williams & Wilkins; 1999. p. 1119-33.
- Flynn JT. Causes, management approaches, and outcome of acute renal failure in children. Curr Opin Pediatr. 1998;10:184-9.
- Ordoñez F, Martínez V. Fallo renal Crónico. Etiología. Epidemiología. En: García Nieto V, Santos Rodríguez F, Rodríguez-Iturbe B (eds.). Nefrología Pediátrica, 2.ª ed. Madrid: Aula Médica; 2006. p. 665-9.
- Espino Hernández M, Granados Molina A. Fallo renal agudo. Diagnóstico. En: García Nieto V, Santos Rodríguez F, Rodríguez-Iturbe B (eds.). Nefrología Pediátrica, 2.ª ed. Madrid: Aula Médica; 2006. p. 633-43.
- Chan JCM, Williams DM, Roth KS. Kidney failure in infants and children. Pediatr Rev. 2002;23(2):47-60.
- Bellomo R, Ronco C, Kellum JA, Mehta RL, Palevsky P and the ADQI workgroup. Acute renal failure—definition, outcome measures, animal models, fluid therapy and information technology needs: The Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group. Critical Care. 2004;8:R204-R212.
- Marcussen N, Schumann J, Campbell P, Kjellstrand C. Cytodiagnostic urinalysis is very useful in the differential diagnosis of acute renal failure and can predict the severity. Ren Fail. 1995;17:721-9.
- Devarajan P. Acute Kidney injury in children: Clinical features, aetiology, evaluation and diagnosis. En http://www.uptodate.com/store. Mattoo Ed. Kim Ed. Dec 2012.
- Glassock RJ, Cohen AH, Adler SG. Primary glomerular disease. En: Brenner & Rectors (eds.). The Kidney. WB Saunders Company; 1997.
- Satla A. Ultrasonography diagnosis of medical nephropathies: the clinician's needs. Arch Ital Urol Androl. 1994;66(4 suppl):11-3.
- Hiraoka M, Hori C, Tsuchida S. Ultrasonographic findings or acute tubulointerstitial nephritis. Am J Nephrol. 1996;16:154-8.
- Alwaidh MH, Cooke RW, Judd BA. Renal blood flow velocity in acute renal failure following cardioplmonary bypass surgery. Acta Paediatr. 1998;87:644-9.
- Brady HR, Brenner BM, Lieberthul W. Acute renal failure. En: Brenner & Rectors (eds.). The Kidney. WB Saunders Company; 1997.
- Sfakianakis GN. Nuclear Medicine in congenital urinary tract anomalies. En: Freeman (ed.). Nuclear Medicine Annual. New York: Raven Press Ltd.; 1991. p. 129-92.
- Edelmann CM, Chrug J, Gerber MA, Travis LB. Renal biopsy: indications, technique and interpretation. En: Edelmann (ed.). Pediatric Kidney Disease. Boston: Little Brown and Company; 1992. p. 499-527.
- Robson AM, Cameron JS. Acute renal failure in the neonate and acute renal failure in the older child. En: Cameron S, Davison AM, Grünfeld JP, Ken D, Ritz E (eds.). Oxford Textbook of Clinical Nephrology. Oxford: Oxford Medical Publications; 1992. p. 1110-23.
- Rahman M, Shad F, Smith M. Acute kidney injury: a guide to diagnosis and management. Am Fam Physician. 2012;86(7):631-9.
- Donckerwolcke R, Broyer M, Chantler M, Rizzoni G. Renal replacemet therapy in children. En: Jacobs C, Kjellstrand C, Koch K, Winchester J (eds.). Replacement of renal function by dialysis, 4th ed. Dordrecht: Kluwer Academic Publishers; 1996. p. 863-95.
- Sinaiko AR. Treatment of hypertension in children. Pediatr Nephrol. 1994;8:603-4.
- Muley Alonso R, Var J, Cilleruelo MJ. Fracaso renal agudo. En: Protocolos diagnósticos y terapéuticos nefrourológicos. Asociación Española de Pediatría; 2001.p.91-102.
- Rey Galán C, Medina Villanueva A, Concha Torre A. Fallo renal agudo. Tratamiento. En: García Nieto V, Santos Rodríguez F, Rodríguez-Iturbe B (eds.). Nefrología Pediátrica, 2.ª ed. Madrid: Aula Médica; 2006. p. 261-8.
- Filler G. Acute renal failure in children: aetiology and management. Pediatr Drugs. 2001;3(11):783-92.
- Conger J. Dialysis and related therapies. Semin Nephrol. 1998;18:533-40.
- Fiaccadori E, Lombardi M, Leonardi S. Prevalence and clinical outcome associated with pre-existing malnutrition in acute renal failure: a prospective cohort study. J Am Soc Nephrol. 1999;10:581-93.
- Flynn J. Choice of dialysis modality for management pediatric acute renal failure. Pediatr Nephrol. 2002;17(1):61-9.
- Mendley SR, Langman CB. Acute renal failure in the pediatric patient. Adv Ren Replace Ther. 1997;4(2 suppl 1):93-101.
- Bunchman TE. Acute peritoneal dialysis access in infant renal failure. Perit Dial Int. 1996;16(suppl):S509-11.
- Warady BA, Bunchaman T. Dialysis therapy for children with acute renal failure: survey results. Pediatr Nephrol. 2000;15(1-2):11-3.
- Journes D. Hemofiltration during cardiopulmonary bypass. Kidney Int. 1998;(Sup 66):S174-7.