Indicaciones de la gammagrafía renal con ácido dimercaptosuccínico en la infección de orina
2 Pediatra. EAP Valle de la Oliva. Majadahonda. Madrid (España).
¿QUÉ ES?
La gammagrafía renal con ácido dimercaptosuccínico (DMSA) es una prueba de imagen que provee información morfológica y cuantitativa de la función renal. Se utiliza para identificar la localización de la infección del tracto urinario (ITU), valorar las lesiones corticales renales (cicatrices) que pueden ocurrir tras ella y diagnosticar hipoplasia renal congénita e infarto renal. Nos permite estudiar la progresión del daño renal desde el insulto inicial hasta el desarrollo de cicatrices.
El radionucleótido más empleado es el Tecnecio 99m (Tc99) con una dosis ajustada al peso (dosis mínima 15 MBq), usando como trazador el DMSA para valorar la imagen cortical. El DMSA es captado en un 60% por los túbulos proximales renales, permitiendo una visualización excelente del parénquima renal, sin la interferencia de la actividad pielocalicial.
Las imágenes son obtenidas entre dos y tres horas después de su administración intravenosa. Se obtienen proyecciones posteriores de ambos riñones para valorar el tamaño renal y la captación cortical, y a continuación se obtienen las imágenes magnificadas en posterior oblicuo, posterior y anterior de ambos riñones1. El nivel de radiación de la prueba es de aproximadamente 1 mSv/examen (equivalente a 16 radiografías de tórax), independientemente de la edad del niño, siempre que la dosis se adapte a la superficie corporal2.
INDICACIONES
Durante la infección de orina
Las ITU constituyen una patología relativamente frecuente, con una prevalencia estimada entre un 2 y un 8% durante la infancia3. Sin embargo, su prevalencia real puede ser subestimada, ya que en ocasiones puede cursar de forma asintomática, el uso de antibióticos por infecciones respiratorias puede dar lugar al tratamiento de una ITU coincidente y, además, la difícil recogida de la orina en condiciones adecuadas dificulta el diagnóstico correcto4. El riesgo de recurrencia se estima en un 12-30% en los primeros 6-12 meses tras la ITU inicial5. Los factores que predisponen a la recurrencia incluyen el reflujo vesicoureteral (RVU) y la disfunción vesical o intestinal.
Las ITU se pueden clasificar en bacteriuria asintomática, cistitis (afectación de vejiga y/o uretra) y pielonefritis aguda (PNA) (inflamación del parénquima renal y pielocalicial). La diferente localización tiene implicaciones pronósticas y terapéuticas, ya que solo las PNA tienen riesgo de daño permanente del parénquima renal, que puede causar hipertensión, proteinuria, complicaciones durante el embarazo o incluso insuficiencia renal crónica. Pero su localización en la práctica clínica no es sencilla.
La clínica de fiebre o dolor lumbar, síntomas clásicos de PNA, no tienen suficiente capacidad discriminativa para realizar el diagnóstico de PNA (coeficiente de probabilidad positivo [CPP] <5, coeficiente de probabilidad negativo [CPN] >0,2)2.
Las alteraciones en la analítica de sangre pueden ayudarnos en la identificación de la PNA. Entre ellas, destacan la presencia de leucocitosis, la elevación de la proteína C reactiva (PCR), el aumento de la velocidad de sedimentación glomerular (VSG) o la elevación de la procalcitonina (PCT). La combinación de todos puede presentar una especificidad aceptable para el diagnóstico de PNA; así, en el contexto de una ITU febril es improbable presentar una PNA si la PCR <20 mg/L, la VSG <10 mm/h, la PCT <0,5 ng/ml o la IL-6 en suero <4 pg/ml (CPN <0,1)2.
La DMSA se considera actualmente el gold standard para detectar afectación del parénquima renal durante una ITU. La correlación entre PNA e hipocaptación de forma aguda en estudios experimentales es excelente, con una sensibilidad del 87% y una especificidad del 100%6. Sin embargo, no distingue entre las lesiones que se resuelven espontáneamente de las que causan cicatriz renal, ni si las lesiones encontradas son preexistentes a la ITU7, y aunque nos permite confirmar el diagnóstico de PNA, existe controversia acerca del momento de realizarla, permaneciendo en discusión si se debe hacer de forma aguda, diferida o ambas8.
De manera diferida tras la infección de orina
Durante los últimos años, se han producido cambios importantes en el manejo de la infección de orina, tanto en el tratamiento como en el seguimiento posterior. Sin embargo, no hay que perder de vista los objetivos, que no se han modificado a lo largo del tiempo: el diagnóstico precoz de la ITU y la identificación de los factores de riesgo de mal pronóstico.
La gammagrafía renal con DMSA busca detectar la presencia de cicatriz renal que puede dar lugar a complicaciones a largo plazo. Su indicación en este momento es muy controvertida, pues encontramos en la bibliografía tanto grupos que siguen recomendándola tras todos los episodios de ITU9 como otros grupos que son más restrictivos10,11.
Entre los factores de riesgo conocidos para el desarrollo de cicatrices renales se incluyen la presencia de RVU especialmente el de alto grado, la edad temprana, el retraso en el inicio del tratamiento antimicrobiano y las infecciones recurrentes12-14. Hay que tener en cuenta que cuando se trata de la primera ITU se desconoce en la mayoría de los casos si el paciente padece un RVU.
Hasta hace unos años, los estudios de imagen habituales en la ITU consistían en la ecografía, la realización de la cistoureterografía miccional seriada (CUMs) para descartar RVU y la realización de la gammagrafía renal con DMSA de forma aguda y/o diferida en 4-6 meses. En el año 2007 se publicaron por parte del National Institute for Health and Clinical Excellence (NICE) de Gran Bretaña las recomendaciones de estudio de imagen tras una ITU15, con una aproximación mucho más restrictiva de lo que se venía haciendo hasta el momento. Estas recomendaciones se basan en la edad del paciente, la respuesta al tratamiento antibiótico y la presencia de una ITU atípica o recurrente (Tabla 1).
Tabla 1. Mostrar/ocultar
A partir de estas recomendaciones se han elaborado guías de actuación en diferentes países que restringen las pruebas de imagen, como las elaboradas en España por la Conferencia de Consenso para el “Manejo diagnóstico y terapéutico de las infecciones del tracto urinario en la infancia”2. Otras guías restringen las pruebas de imagen, pero menos, especialmente en menores de seis meses16.
Muchos autores sostienen que con la realización de estudios en casos tan selectivos se pierden pacientes de riesgo con RVU, anomalías congénitas17,18 o cicatrices renales19, por lo que se necesitan más estudios que nos permitan validar las guías NICE7.
Otra alternativa propuesta en la literatura para la búsqueda de los pacientes con RVU es reemplazar la CUMs por la gammagrafía renal con DMSA en fase aguda, y solo realizar la CUMs si la ecografía renal o la gammagrafía renal con DMSA están alteradas (esta aproximación diagnóstica se denomina top-down approach)20,21.
Por tanto, la respuesta definitiva a la cuestión sobre qué prueba de imagen realizar tras una primera ITU febril no está resuelta, necesitándose más estudios que validen los diferentes protocolos sugeridos hasta el momento. El clínico debe conocer las diferentes opciones y su uso apropiado en cada niño en particular.
Lo que proponemos a continuación es realizar el estudio de imagen con Tc99-DMSA a los seis meses de la primera infección de orina febril si se cumple alguna de las siguientes circunstancias:
- Paciente <6 meses de edad en el momento de la infección.
- Ha precisado ingreso.
- El patógeno es diferente a E. coli en el urocultivo.
- No ha tenido buena respuesta al tratamiento (>48 horas febril).
- Si las pruebas de imagen previas no han sido normales (incluidas prenatales).
- Si hay antecedente familiar de reflujo.
- Si tiene historia de disfunción vesical.
- Si los reactantes de fase aguda en el momento de la infección estuvieron elevados.
- Si tuvo afectación de la función renal.
- Sospecha de mal seguimiento.
Hipoplasia renal
Aunque la gammagrafía renal con DMSA es el método de elección para la identificación del daño renal, no nos permite diferenciar la cicatriz renal adquirida tras una PNA del daño congénito. Especialmente en los niños que padecen un RVU de alto grado, la afectación renal observada tras una PNA se debe con más frecuentencia a una displasia renal asociada al reflujo que a una cicatriz adquirida postpielonefrítica22.
Ante la sospecha de una displasia o hipoplasia renal, se recomienda la realización de la gammagrafía renal con DMSA para cuantificar la función del riñón afecto y su evolución en el tiempo.
INTERPRETACIÓN
En la interpretación de los resultados de la gammagrafía renal con DMSA debemos tener en cuenta:
- La función diferencial de cada riñón debe estar entre el 45 y el 55%. La captación del Tc99-DMSA por cada riñón es una medida precisa del funcionamiento relativo de la masa tubular, y en la mayoría de los casos se correlaciona bien con el porcentaje de filtración glomerular y otros parámetros de la función renal.
- El contorno de ambos riñones debe ser redondeado y liso, sin sugerir lesión, con una menor concentración en la zona del sistema colector. Los defectos en la captación cortical del radiofármaco son patológicos. Se acepta como normal la forma triangular en niños pequeños, riñón alargado que corresponde a una imagen rotada, en ocasiones con forma de pera. El polo superior en ocasiones puede tener menor captación por la hipercaptación de las columnas de Bertin. La parte superolateral del polo superior del riñón izquierdo puede aparecer aplanada debido a la superposición del bazo.
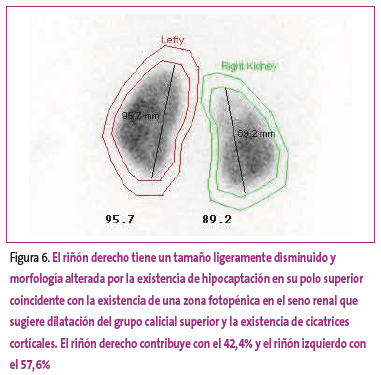
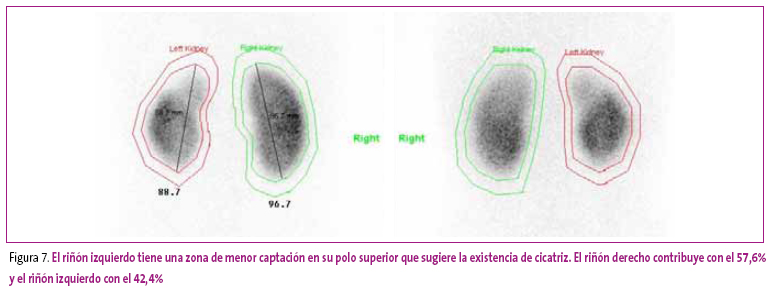
Se diagnostica PNA cuando existe un área con disminución de la captación con el contorno renal preservado o cuando el riñón está aumentado de tamaño con una disminución difusa en la captación. La cicatriz renal se observa cuando hay un defecto en la captación asociado a pérdida cortical o disminución del volumen renal. Un riñón pequeño con disminución difusa de la captación del isótopo y disminución de la función diferencial renal se considera una hipodisplasia21. En las Figuras 1-7 se muestran diferentes imágenes obtenidas en el estudio postpielonefrítico.
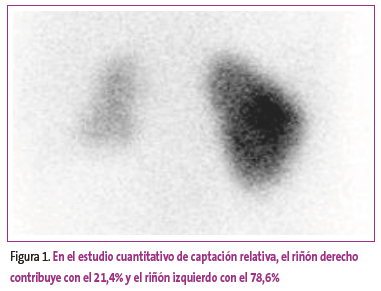
Figura 1. Mostrar/ocultar
Figura 2. Mostrar/ocultar
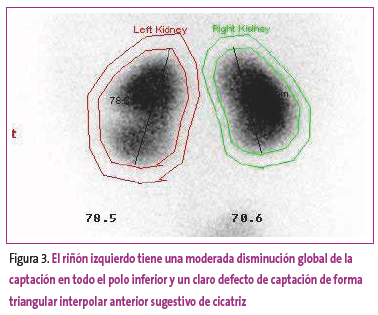
Figura 3. Mostrar/ocultar
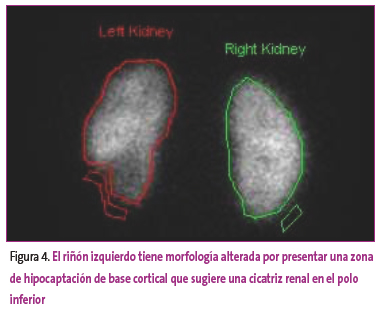
Figura 4. Mostrar/ocultar
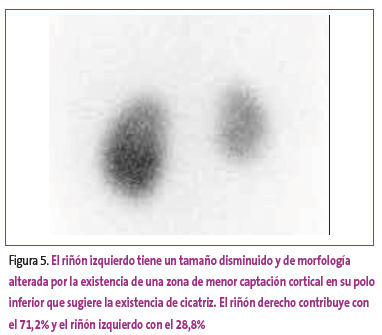
Figura 5. Mostrar/ocultar
Figura 6. Mostrar/ocultar
Figura 7. Mostrar/ocultar
Según Goldraich23, las cicatrices se pueden clasificar en cuatro tipos:
- Tipo 1: no más de dos áreas de cicatriz.
- Tipo 2: más de dos áreas de cicatriz con áreas de parénquima renal entre ellas.
- Tipo 3: daño generalizado en la totalidad del riñón (contracción global del riñón con o sin cicatrices en su contorno).
- Tipo 4: riñón muy reducido con poca o ninguna captación (<10% de FRR).
BIBLIOGRAFÍA
- Piepsz A, Colarinha P, Gordon I, Hahn K, Olivier P, Roca I, et al; Paediatric Committee of the European Association of Nuclear Medicine. Guidelines for 99mTc-DMSA scintigraphy in children. Eur J Nucl Med. 2001;28(3):BP 37-41.
- Grupo de trabajo de la Guía de Práctica Clínica sobre Infección del Tracto Urinario en la Población Pediátrica. Guía de Práctica Clínica sobre Infección del Tracto Urinario en la Población Pediátrica. Plan de Calidad para el Sistema Nacional de Salud del Ministerio de Sanidad, Política Social e Igualdad. Instituto Aragonés de Ciencias de la Salud; 2011. Guías de Práctica Clínica en el SNS: I+CS No 2009/01.
- Uhari M, Nuutinen M. Epidemiology of symptomatic infections of the urinary tract in children. BMJ. 1988;297:450-2.
- Espinosa L. Infección urinaria. En: García Nieto V, Santos F, Rodríguez-Iturbe (eds.). Nefrología Pediátrica, 2.ª ed. Madrid: Aula Médica; 2006.
- Conway PH, Cnaan A, Zaoutis T, Henry BV, Grundmeier RW, Keren R. Recurrent urinary tract infections in children: riskfactors and association with prophylactic antimicrobials. JAMA. 2007;298:179-186.
- Rushton HG, Majd M. Dimercaptosuccinic acid renal scintigraphy for the evaluation of pyelonephritis and scarring: a review of experimental and clinical studies. J Urol. 1992;148(5 Pt 2):1726-32.
- Saadeh SA, Mattoo TK. Managing urinary tract infections. Pediatr Nephrol. 2011;26(11):1967-76.
- Printza N, Farmaki E, Piretzi K, Arsos G, Kollios K, Papachristou F. Acute phase 99mTc-dimercaptosuccinic acid scan in infants with first episode of febrile urinary tract infection. World J Pediatr. 2012;8(1):52-6.
- Montini G, Tullus K, Hewitt I. Febrile urinary tract infections in children. N Engl J Med. 2011;365(3):239-50.
- Hannula A, Venhola M, Perhomaa M, Pokka T, Renko M, Uhari M. Imaging the urinary tract in children with urinary tract infection. Acta Paediatr. 2011;100(12):e253-259.
- Hewitt IK, Montini G. Reduced imaging after urinary tract infection: are benefits accompanied by adverse risks? Arch Pediatr Adolesc Med. 2011;165(11):1047-8.
- Hellerstein S. Long-term consequences of urinary tract infections. Curr Opin Pediatr. 2000;12:125-8.
- Coulthard MG, Verber I, Jani JC, Lawson GR, Stuart CA, Sharma V, et al. Can prompt treatment of childhood UTI prevent kidney scarring? Pediatr Nephrol. 2009;24:2059-63.
- Printza N, Farmaki E, Piretzi K, Arsos G, Kollios K, Papachristou F. Acute phase 99mTc-dimercaptosuccinic acid scan in infants with first episode of febrile urinary tract infection. World J Pediatr. 2012;8(1):52-6.
- National Institute for Health and Clinical Excellence. Urinary tract infection in children. London: NICE, 2007 [en línea]. Disponible en: http://guidance.nice.org.uk/CG54/NICEGuidance/pdf/English
- Ammenti A, Cataldi L, Chimenz R, Fanos V, La Manna A, Marra G, et al.; Italian Society of Pediatric Nephrology. Febrile urinary tract infections in young children: recommendations for the diagnosis, treatment and follow-up. Acta Paediatr. 2012;101(5):451-7.
- Coulthard MG. Is reflux nephropathy preventable, and will the NICE childhood UTI guidelines help? Arch Dis Child. 2008;93:196-9.
- Coulthard MG. NICE on childhood UTI: Nasty processes produce nasty guidelines. BMJ. 2007;335:463.
- Tse NK, Yuen SL, Chiu MC, Lai WM, Tong PC. Imaging studies for first urinary tract infection in infants less than 6 months old: can they be more selective? Pediatr Nephrol. 2009;24:1699-703.
- Herz D, Merguerian P, McQuiston L, Danielson C, Gheen M, Brenfleck L. 5-year prospective results of dimercapto-succinic acid imaging in children with febrile urinary tract infection: proof that the top-down approach works. J Urol. 2010;184:1703-9.
- Lee MD, Lin CC, Huang FY, Tsai TC, Huang CT, Tsai JD. Screening young children with a first febrile urinary tract infection for high-grade vesicoureteral reflux with renal ultrasound scanning and technetium-99 m-labeled dimercaptosuccinic acid scanning. J Pediatr. 2009;154:797-802.
- Peters C, Rushton HG. Vesicoureteral reflux associated renal damage: congenital reflux nephropathy and acquired renal scarring. J Urol. 2010;184:265-73.
- Goldraich IH, Goldraich NP, Ramos OL. Classification of reflux nephropathy according to findings at DMSA renal scan. Eur J Pediatr. 1983;140:212.