Debut extremo de anemia de Blackfan-Diamond
2 Servicio e Pediatría. Hospital Lluís Alcanyís. Xátiva. Valencia. (España).
PUNTOS CLAVE
- Un correcto sistema de triaje para priorizar la atención sanitaria en los servicios de Atención Primaria y en las Urgencias Hospitalarias es importante.
- El triángulo de evaluación pediátrica (TEP) es una herramienta rápida y tremendamente útil para la valoración inicial del paciente pediátrico; estructura la valoración subjetiva que todo sanitario hace al ver por primera vez a un paciente.
- El personal que atiende urgencias pediátricas (centro de salud y hospitales) debe permanecer en continua formación y actualización para la estabilización de pacientes agudos.
- Es importante que el pediatra de Atención Primaria conozca la anemia de Blackfan-Diamond, una causa muy poco probable de anemia. La enfermedad se manifiesta con distintos grados de gravedad, presentan un mayor riesgo de enfermedades relacionadas con la médula ósea y con los años pueden tener problemas hormonales.
CASO CLÍNICO
Lactante de 3 meses que acude al Servicio de Urgencias por irritabilidad y rechazo de las tomas de varios días de duración. Toma lactancia artificial. No está tomando fármacos. No ha estado en contacto con tóxicos ni animales. Había presentado síntomas catarrales previos por los que había consultado con su pediatra.
Antecedentes personales: niña prematura, de 34 semanas con ingreso por ictericia no inmune. Sin antecedentes familiares relevantes. Hermana de 4 años, sana.
Presenta un TEP alterado, con regular aspecto general y palidez extrema; tiraje subcostal bien tolerado.
Constantes: saturación de oxígeno del 100%, frecuencia cardiaca de 175 lpm, frecuencia respiratoria de 60 rpm, con presión arterial 100/70 y temperatura de 37,9 °C.
En el examen físico destaca una coloración muy pálida de piel y mucosas, relleno capilar enlentecido y mucosas secas. Se encuentra consciente y orientada. Tiraje subcostal bien tolerado. Se observa un soplo cardiaco y hepatomegalia.
Hemograma: hemoglobina 1,8 g/dl, hematocrito 5,5%, reticulocitos 0,79%, volumen corpuscular medio de 92 fl, leucocitos 13,4×103/µl, neutrófilos 51%, plaquetas 455×103/µl, pruebas de función hepática y renal normales. Coagulación: Quick 39%, tiempo de tromboplastina parcial activado de 38 segundos (control de 30 segundos). Gasometría venosa: pH de 7.18, pCO2 de 20, HCO3 de 7,6, EBA de -18.
Se canaliza vía periférica y se transfunden de extrema urgencia, previa administración de un bolo de suero salino fisiológico (SSF), concentrado de hematíes (CH) a 15 ml/kg y posteriormente un segundo bolo de SSF. Al no poderse descartar proceso infeccioso, se administra una dosis de antibiótico intravenoso.
Tras la estabilización inicial, es trasladada al hospital terciario de referencia, donde precisó ingreso en la Unidad de Cuidados Intensivos Pediátricos (UCIP). Requirió la canalización de una vía central, y dos nuevas transfusiones de CH, con lo que se consiguió normalizar la frecuencia cardiaca y la función hemodinámica sin precisar inotrópicos. Se amplió el estudio de anemias mediante aspirado de médula ósea, donde se observó eritroblastopenia.
Posteriormente, precisó controles cardiacos y renales por repercusión sistémica con cardiomegalia, con dilatación de cavidades izquierdas que precisó captopril, normalización de la función sistólica y buena evolución.
Actualmente, está en seguimiento por Hematología, con confirmación genética de anemia de Blackfan-Diamond, y se mantiene estable sin nuevas transfusiones y buena curva ponderal con corticoides a dosis bajas.
INTRODUCCIÓN
El síndrome de Blackfan-Diamond fue descrito por primera vez en 1938 por Diamond, como una anemia hipoplásica congénita1. En la actualidad, se encuentra incluido entre los llamados síndromes de insuficiencia medular congénita. Se han descrito 500 casos en la literatura médica2. La incidencia estimada en Europa es de unos 7,3 casos por cada millón de recién nacidos vivos. Aunque la mayoría de los casos son esporádicos, se han hallado familias con patrones de herencia tanto dominante como recesiva2.
El origen está en un trastorno de los síntomas de los ribosomas. La mutación causante es detectada en un 50% de los casos, la más frecuente es la que afecta a la proteína ribosómica RPS19 (25%). El resto se trata de mutaciones menos frecuentes, deleciones no identificables y casos esporádicos3.
En algunos casos se asocia a parto prematuro (20%), bajo peso al nacer (16-26%) y retraso del crecimiento (22%). La edad media del diagnóstico es entre 2 y 4 meses. Al nacimiento se identifican un 13%, y al año de vida el 90%. Suelen debutar con clínica de palidez2.
Se caracteriza por un defecto de producción medular, que afecta de forma específica a la serie eritroide. Asocia anomalías congénitas hasta en un 50% de los pacientes y la predisposición al desarrollo de otras neoplasias, fundamentalmente leucemias mieloides y osteosarcomas.
El tratamiento de primera elección son los corticoides, asociados inicialmente al soporte transfusional. Actualmente, el único tratamiento curativo es el trasplante alogénico de progenitores hematopoyéticos1.
DISCUSIÓN
Presentamos la estabilización inicial, el manejo y la evolución de una anemia grave en una lactante de 3 meses. Las anemias leves no suelen presentar afectación sistémica, pero las anemias tan graves como la de nuestra paciente presentan afectación multisistémica, aún con un establecimiento progresivo o crónico. Por dicho motivo necesitan atención urgente. Es necesaria una correcta evaluación de los pacientes que acuden por motivos urgentes, diferenciando la atención urgente del diagnóstico.
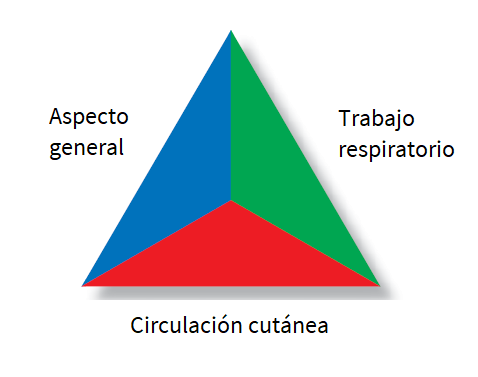
El objetivo fundamental del triaje es que los pacientes de gravedad y con mayor riesgo de deterioro si se demora el tratamiento sean atendidos lo antes posible. El TEP (Figura 1) permite una impresión inicial a través de información esencial del estado funcional y ayuda a establecer prioridades. Se realiza independientemente del motivo de consulta, viendo y escuchando, sin tocar y sin toma de constantes, no requiere ninguna herramienta más allá de la visión y el oído del facultativo. Identifica gravedad o urgencia a través de niveles, ejemplificándose con los tres lados de un triángulo: el aspecto general, el trabajo respiratorio y la circulación. Los pacientes sin afectación de ningún lado corresponderían a niveles IV-V; alteración de un lado, nivel III; alteración de dos lados del triángulo, nivel II; y alteración de tres lados del triángulo nivel I. Los pacientes con TEP alterado deben ser atendidos con prioridad4. Los pacientes clasificados dentro del nivel I deben ser atendidos inmediatamente, los del nivel II en 15 minutos, los de los niveles III y IV en 30 y 60 minutos respectivamente. En los clasificados como nivel V el tiempo de demora es hasta 120 minutos.
Figura 1. Triángulo de evaluación pediátrica (TEP). Mostrar/ocultar
Aunque el TEP tenga tres lados, el más importante es el que valora la apariencia, que es un indicador del nivel de perfusión y oxigenación cerebral. Cuando se encuentra alterada, es un signo de disfunción del sistema nervioso central. Nuestra paciente tenía regular aspecto general con irritabilidad, además de palidez y taquicardia, que alteran el lado de circulación cutánea, y el tiraje respiratorio completa el lado del trabajo respiratorio, por lo que, en unos pocos segundos y en cualquier medio se puede identificar que requiere manejo inicial ABCDE (vía aérea, respiración, circulación, neurológico y exposición)4.
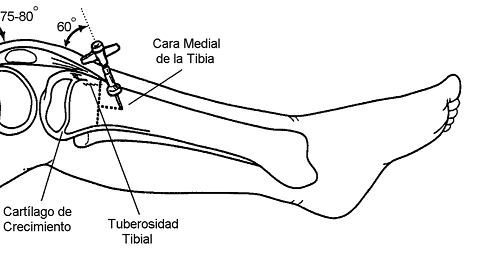
Se debe administrar oxígeno, monitorizar, intentar canalizar vía periférica para administrar fluidos, medicación y extraer analítica. Este manejo se debe realizar en cualquier centro sanitario; la extracción analítica es parte del manejo secundario. Se plantea ante la dificultad para canalizar vía periférica la opción de vía intraósea, en este caso en meseta tibial interna por edad menor de 6 años5.
Figura 2. Localización de vía intraósea en menores de 6 años. Mostrar/ocultar
En todo momento, a pesar de la gravedad, nuestra paciente se mantiene consciente y activa, aunque muy irritable, pues se le están realizando maniobras invasivas y dolorosas.
La causa más frecuente de anemia es la anemia ferropénica y más de la mitad de los pacientes estarán asintomáticos. Pueden ser síntomas y signos de anemia: irritabilidad, palidez, dificultad en la alimentación, taquicardia, soplo, esplenomegalia… todos ellos presentes en nuestra paciente6.
La palidez extrema, que es característica en la presentación de la anemia de Blackfan-Diamond, junto con la irritabilidad y la taquicardia alertan de una posible descompensación.
En la clasificación etiológica de las anemias, diferenciamos las producidas por el aumento de la destrucción o por la alteración en la producción; entre ellas se encuentra la anemia de Blackfan-Diamond, por inhibición de la médula ósea. Por ello, para distinguir entre las posibilidades diagnósticas de una anemia en los primeros meses de vida, sin alteración del resto de series, es de utilidad el recuento reticulocitario.
En el caso de una anemia aplásica congénita, el diagnóstico diferencial debería realizarse, por un lado, con una eritroblastopenia transitoria infantil, que afecta a niños sanos entre 1 mes y 8 años (con un pico de frecuencia a los 2 años), frecuentemente tras una viriasis (Parvovirus B19). Es autolimitada y benigna7 y cursa con anemia normocrómica, normocítica, con reticulocitos bajos. La otra posibilidad es una anemia de Blackfan-Diamond, normocrómica, macro- o normocítica, con reticulocitos bajos, que aparece en el primer año de vida. La médula es normocelular, con alteración selectiva de los precursores eritrocitarios8,9.
El diagnóstico de la anemia de Blackfan-Diamond se puede plantear en todo lactante menor de un año con aplasia pura de la serie roja. Se debe completar el estudio con cultivos y pruebas genéticas8.
CONCLUSIONES
Por todo lo anterior, como pediatras debemos saber identificar y priorizar las necesidades urgentes de nuestros pacientes. El primer punto de atención sanitaria suele ser el pediatra de Atención Primaria. La utilización del TEP puede ser de gran utilidad para identificar y estabilizar al paciente que lo precise antes de trasladarlo a un hospital. En nuestro caso el ABCDE se puede realizar en la mayoría de centros de Atención Primaria, salvo la transfusión de CH.
Para un correcto diagnóstico y evolución es imprescindible una buena historia, una correcta exploración y plantear un buen diagnóstico diferencial.
BIBLIOGRAFÍA
- Pérez Navarro JL, Ibarra de la Rosa I, Camino León R. La Pediatría a través de casos clínicos. Madrid: Ergon; 2014.
- Bernácer M, Leal A. Anemias no hemolíticas. An Pediatr Contin. 2004;2:22-30.
- Anemia de Diamond-Blackfan. En: Genetic and Rare Diseases Information Center (GARD) [en línea] [consultado el 04/12/2019]. Disponible en: https://rarediseases.info.nih.gov/espanol/12933/anemia-de-diamond-blackfan
- Zúñiga RV. Triángulo de evaluación pediátrica. Pediatr Integr. 2014;18:320-3.
- Accesos vasculares. En: Curso Europeo de Soporte Vital Pediátrico. Manual del curso de reanimación cardiopulmonar básica y avanzada pediátrica. 1.ª edición. Berlaar, Bélgica: Consejo Europeo de Resucitación; 2010. p. 57-62.
- Pavo García MR, Muñoz Díaz M, Baro Fernández M. Anemia en edad pediátrica. Form Act Pediatr Aten Prim. 2016;9:149-55.
- Tordecilla JC, Vega ÁG, Tordecilla RF. Eritroblastopenia transitoria de la infancia: presentación de tres casos clínicos. Rev Chil Pediatr. 2009;80:539-44.
- San Román Pacheco S, Mozo del Castillo Y. Síndrome anémico. En: Guerrero-Fernández J, Cartón Sánchez A, Barreda Bonís A, Menéndez Suso J, Ruíz Domínguez J. Manual de diagnóstico y terapéutica en Pediatría. 6.ª edición. Madrid: Panamericana; 2018. p. 1117-30.
- Sandoval C. Anemia in children due to decreased red blood cell production. En: UpToDate [en línea] [consultado el 04/12/2019]. Disponible en: www.uptodate.com/contents/anemia-in-children-due-to-decreased-red-blood-cell-production
- Mondragón-Cardona A, Alzate-Carvajal V, Ortiz-Machacón J, Vásquez FJ. Anemia de Diamond Blackfan, un diagnóstico de exclusión. Rev Médica Risaralda. 2017;23:45-7.