Adenopatía cervical persistente: enfermedad de Rosai-Dorfman
2 Pediatra. UGC Delicias. Málaga (España).
3 Servicio de Infectología Pediátrica. Hospital Materno Infantil de Málaga. Málaga. (España).
PUNTOS CLAVE
- Las adenopatías cervicales crónicas son un motivo de consulta frecuente en las consultas de Atención Primaria.
- La causa más frecuente en nuestro medio es la adenopatía reactiva, seguida de la infección por micobacterias atípicas.
- Es fundamental la realización de una buena historia clínica, exploración y pruebas complementarias para ayudar a esclarecer la etiología y valorar la necesidad de derivación a la consulta del especialista.
- Ante un diagnóstico incierto debemos plantearnos la necesidad de realizar una biopsia ganglionar.
INTRODUCCIÓN
Las adenopatías son un motivo de consulta muy frecuente en las consultas de Atención Primaria.
Se definen como un ganglio linfático patológico debido a la alteración de alguna de sus características (aumento de tamaño, presencia de dolor, consistencia aumentada, bordes irregulares, adherencia a planos profundos o estructuras adyacentes o alteración de la piel suprayacente). Habitualmente son de etiología infecciosa o reactiva, aunque en algunas ocasiones pueden ser la expresión inicial de patologías malignas, de ahí la importancia de realizar un correcto diagnóstico diferencial para evitar retrasos diagnósticos1.
Según su duración, las adenopatías pueden clasificarse en agudas (<3 semanas), subagudas (3-6 semanas) o crónicas (>6 semanas). La persistencia de la adenopatía en el tiempo o la modificación rápida de alguna de sus características suele ir ser indicador de patologías más severas2.
CASO CLÍNICO
Niña de 2 años y 8 meses que consulta por adenopatía cervical derecha de 3 meses de evolución aproximadamente. No refiere cambios de tamaño ni consistencia de la adenopatía desde su inicio, se ha mantenido afebril en todo momento y no ha presentado sintomatología constitucional asociada. Al inicio del cuadro recibió un ciclo de tratamiento antibiótico con amoxicilina sin presentar mejoría clínica. Viven en medio rural, aunque no refiere contacto reciente con animales. No ha realizado viajes al extranjero ni ha convivido con personas enfermas o tosedoras habituales.
Como antecedentes personales, destaca un embarazo controlado sin patología asociada, con finalización eutócica y un periodo neonatal sin incidencias. Recibió lactancia materna exclusiva durante 4 meses, realizando en el momento de la consulta una alimentación variada y adecuada a su edad. Presentó un desarrollo psicomotor adecuado. Vacunación correcta hasta la fecha, incluyendo vacuna antineumocócica. En cuanto a alergias, presentó una alergia a la proteína de leche de vaca (APLV) IgE mediada en primera infancia ya resuelta. No refiere alergias medicamentosas conocidas hasta el momento. Como enfermedades anteriores, refiere una infección del tracto urinario por E. coli dos años antes que trataron con antibioterapia oral con cefixima, con buena respuesta.
Entre sus antecedentes familiares, destaca una abuela materna fallecida a consecuencia de un cáncer gástrico diagnosticado a los 51 años de edad y una prima diagnosticada de leucemia a los 4 años, actualmente en tratamiento. Ambos padres están sanos y no tiene hermanos.
En la exploración física se constata un peso y talla dentro de percentiles normales. Presenta un excelente estado general con hidratación, nutrición y perfusión adecuadas. A nivel del cuello se palpa una tumoración laterocervical derecha de 5-6 cm de diámetro máximo, de consistencia dura, no adherida a planos profundos, no dolorosa a la palpación y acompañada de múltiples adenopatías centimétricas ipsilaterales. No se identifican adenopatías palpables a otros niveles. La auscultación cardiorrespiratoria no revela alteraciones. No se evidencian megalias en la palpación abdominal. La exploración del resto de sistemas es normal.
Se realiza en un primer momento las siguientes pruebas complementarias:
- Analítica sanguínea: hemograma y coagulación normales. Frotis de sangre periférica sin alteraciones. Bioquímica normal (perfil hepático y renal) salvo una ferritina ligeramente aumentada (94 ng/ml). Proteína C reactiva (PCR) negativa. Velocidad de sedimentación globular (VSG) ligeramente aumentada (45 mm). Inmunoglobulinas y subpoblaciones linfocitarias dentro de límites normales, salvo una hipergammaglobulinemia a expensas de IgG (1970 mg/dl). Serología negativa a Herpesvirus, citomegalovirus (CMV), Toxoplasma, virus de la inmunodeficiencia humanada (VIH) y Brucella; y anticuerpos antivirus de Epstein Barr (VEB) IgM positivos (IgG negativos).
- Prueba de la tuberculina leída a las 48 y 72 horas de 0 mm.
- Radiografía de tórax: sin alteraciones.
- Ecografía cervical: adenopatías laterocervicales de tamaño significativo (la mayor presenta un diámetro de 4 cm) que conserva hilio graso, de características inespecíficas.
- Ecografía abdominal: discreto aumento de tamaño esplénico y adenopatías mesentéricas múltiples con aspecto de benignidad.
Inicialmente se realizó diagnóstico de síndrome mononucleósico secundario a virus de Epstein-Barr (VEB), pero tras 6 meses de seguimiento en consulta de Atención Primaria, persiste la adenopatía inalterada por lo que se decide derivación a consulta de Infectología Pediátrica del hospital de referencia para ampliar estudio.
DIAGNÓSTICO DIFERENCIAL Y JUICIO CLÍNICO
El signo guía que emplearemos para nuestro diagnóstico diferencial es la adenopatía cervical persistente. Por tanto, en el diagnóstico diferencial deben incluirse las patologías que cursen con adenopatía crónica y que quedan resumidas en la Tabla 1.
Tabla 1. Diagnóstico diferencial ante adenopatía crónica. Mostrar/ocultar
A continuación, de manera sucesiva, iremos descartando todas las posibilidades hasta llegar a nuestra principal sospecha clínica:
- Gracias a la serología realizada en un primer momento pueden descartarse patologías infecciosas como citomegalovirus (CMV), toxoplasmosis, virus de la inmunodeficiencia humana y brucelosis. En un primer momento, obtuvimos serología positiva para infección aguda por VEB, pero el que no haya mejorado la clínica de la paciente varios meses después nos debe hacer repetir la serología y, si es posible, pruebas de diagnóstico molecular, y sospechar otras patologías. En una segunda analítica, se obtuvo resultado de serología negativo para VEB (IgG e IgM), CMV, Leishmania, Toxoplasma, Bartonella y Brucella. Con estos resultados, descartamos síndrome mononucleósico e infección por los principales patógenos causantes de adenopatías crónicas.
Tabla 2. Diagnóstico diferencial infección por micobacterias. Mostrar/ocultar
- La infección por micobacterias es, en ocasiones difícil de diagnosticar; es importante diferenciar entre infecciones por Mycobacterium tuberculosis e infección por micobacterias atípicas. Las diferencias entre ambos tipos de infecciones se resumen en la Tabla 2. En nuestra paciente se realizó prueba de la tuberculina (0 mm) y Quantiferón® con resultado negativo. Con estos datos, es muy improbable una infección tuberculosa, no obstante, la infección por micobacterias atípicas es posible, y la única forma de descartarla es mediante una biopsia ganglionar.
- La patología hematológica (leucemias y linfomas) suele asociar con frecuencia otros síntomas, fundamentalmente síntomas constitucionales, y alteraciones en el hemograma y frotis de sangre periférica. Además, se hubiera evidenciado progresión de la enfermedad a lo largo del tiempo. Dentro de esta patología, lo más frecuente es una enfermedad leucémica, ya que es la neoplasia más frecuente en niños y los linfomas no suelen aparecer antes de los 4 años de edad. No obstante, la biopsia de la adenopatía seria lo único que nos confirmaría el diagnóstico.
Tabla 3. Diagnóstico diferencial histiocitosis3. Mostrar/ocultar
- La histiocitosis recoge un grupo heterogéneo de enfermedades de causa desconocida que se caracterizan por la proliferación de células del sistema mononuclear fagocítico (monocitos, macrófagos, células dendríticas) en diferentes órganos y sistemas. Los principales tipos de histiocitosis que son compatibles con el cuadro clínico de la paciente se resumen en la Tabla 3. La única forma de confirmar el diagnóstico es mediante estudio histológico de la adenopatía.
- Las adenopatías secundarias a tratamiento crónico con determinados fármacos se descartaron de inmediato, ya que nuestra paciente no estaba recibiendo ni había recibido previamente ninguno de estos fármacos.
- La sarcoidosis es una enfermedad multisistémica de causa desconocida, poco frecuente en niños pequeños, y que puede presentarse con afectación de múltiples órganos y tejidos, entre ellos los ganglios linfáticos (sarcoidosis ganglionar). La forma frecuente de presentación en niños <4 años es con la triada clásica de rash cutáneo, uveítis y artritis. Aunque este diagnóstico es poco probable en nuestra paciente, la única forma de hacerlo es mediante estudio histológico de la biopsia ganglionar.
- Por último, las enfermedades de Castleman y de Kikuchi-Fujimoto son patologías de causa desconocida donde predomina la proliferación linfoide. Pueden presentarse en forma de adenopatía aislada o asociada a síntomas constitucionales. El diagnóstico definitivo se establecerá mediante estudio histológico.
- Por tanto, dentro del diagnóstico diferencial realizado, nos quedamos con las siguientes posibilidades diagnósticas: infección por micobacterias atípicas, neoplasias hematológicas (leucemias/linfomas), histiocitosis, sarcoidosis, enfermedad de Castleman y enfermedad de Kikuchi-Fujimoto. La única manera de llegar a un diagnóstico correcto es mediante la realización de una biopsia de la adenopatía, con posterior estudio histológico de la misma.
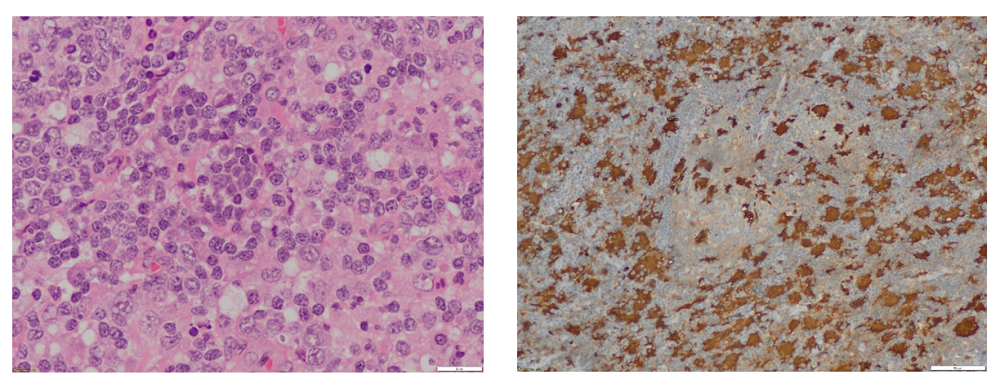
Finalmente se decidió la realización de una biopsia ganglionar en nuestra paciente. El estudio infeccioso de la muestra (microbiología molecular para VEB, CMV, Toxoplasma y Bartonella; estudio de micobacterias; Gram y cultivo) fue negativo. El estudio histológico mostró una imagen (Figura 1) compatible con histiocitosis sinusal con linfadenopatía masiva, también conocida como enfermedad de Rosai-Dorfman (ERD).
Figura 1. Imagen histológica de enfermedad Rosai Dorfman. Mostrar/ocultar
Tras establecer el diagnóstico, se realizó estudio de extensión mediante resonancia magnética (RM), donde se evidenció una afectación nodal exclusiva ,sin compromiso de órganos vitales, calificándose de ERD leve y no iniciando, por tanto, ningún tratamiento salvo la observación y seguimiento en consulta de Oncología Pediátrica. La adenopatía cervical inicial por la que consultó nuestra paciente fue completamente resecada en la cirugía para la toma de biopsia.
HISTIOCITOSIS SINUSAL CON LINFADENOPATÍA MASIVA O ENFERMEDAD DE ROSAI DORFMAN (ERD)
Etiología y epidemiología
Se trata de una patología histiocítica proliferativa rara, con una incidencia aproximada de 1 caso por cada 200 000 niños, definida por hallazgos histológicos, que afecta principalmente a los ganglios linfáticos, sobre todo los cervicales, y en un alto porcentaje tiene afectación extraganglionar.
Aunque la etiología no está del todo definida hoy en día, se sabe que la migración de monocitos mediada por citoquinas (IL-6) tras un determinado estímulo se ha relacionado con esta activación y proliferación de los histiocitos a nivel de los ganglios linfáticos. Los estímulos pueden ser muy variados, pero se han descrito principalmente enfermedades autoinmunes, hematológicas y, lo más frecuente, infecciosas (los patógenos que más se han asociado a esta enfermedad son el VEB, el herpesvirus 6 y el parvovirus B19).
Aunque puede ocurrir a cualquier edad, afecta con mayor frecuencia a niños o adultos jóvenes, con predilección por el sexo masculino (3:1) y también se ha asociado a una mayor incidencia en raza negra4.
Clínica
Sus manifestaciones clínicas iniciales incluyen la afectación nodal (en un 90% de los casos) junto con manifestaciones extranodales por extensión a cualquier región corporal en un 43% de los casos. También es posible la afectación extranodal sin afectación ganglionar, aunque en este caso se prefiere usar el término de ERD en lugar de histiocitosis sinusal con linfadenopatía masiva.
- Afectación nodal: suele presentarse como una linfadenopatía cervical masiva, bilateral y dolorosa, aunque pueden aparecer adenopatías en otras localizaciones (de mayor a menor frecuencia: inguinal, axilar, mediastínico/hiliar, retroperitoneales). Asimismo, puede asociar síntomas inespecíficos como fiebre, malestar general, sudores nocturnos y pérdida de peso, aunque no aparecen en todos los casos5.
- Afectación extranodal: puede haber afectación prácticamente a cualquier nivel, destacando principalmente piel (17%), tracto respiratorio superior (16%), ojos y tejido retroorbitario (11%), tejido óseo (11%), sistema nervioso central (7%), glándulas salivales (7%), pulmón (3%), aparato genitourinario (3%), aparato digestivo (<1%), corazón (<1%) y tiroides (<1%). Esta afectación extranodal puede ocurrir antes, durante o después de la afectación ganglionar. En la Tabla 4 se resume la presentación clínica típica de la afectación extranodal4.
Tabla 4. Presentación clínica formas extranodales. Mostrar/ocultar
En la forma extranodal, la afectación cutánea es la más frecuente, como ya se ha comentado. Suele presentarse como lesiones inespecíficas que incluyen pápulas, nódulos, máculas, placas, pústulas, lesiones acneiformes y psoriasiformes; de coloración marronácea. Habitualmente suelen ser asintomáticas, aunque se han descrito algunas dolorosas o pruriginosas. La localización puede ser muy variada, aunque es más frecuente encontrarlas a nivel de la región cefálica, tronco proximal y extremidades.
Existe una variante de la enfermedad, denominada ERD cutánea pura, con una incidencia del 3% dentro de la afectación cutánea, caracterizada por una afectación cutánea exclusiva, sin adenopatías ni manifestaciones sistémicas asociadas. Predomina en el sexo femenino, y es más frecuente en pacientes adultos. Aunque puede manifestarse de distintas formas, habitualmente aparece como pápulas o nódulos firmes e indurados6.
Diagnóstico
Su diagnóstico es anatomopatológico con existencia de expansión del seno ganglionar y un infiltrado polimorfo con presencia de histiocitos positivos por inmunohistoquímica a la proteína S-100 y presencia casi constante del fenómeno de emperipolesis (linfofagocitosis); las atipias nucleares son escasas. En la afectación extranodal el patrón histológico es similar, pero hay mayor fibrosis y menor número de histiocitos diagnósticos, así como menor frecuencia de emperipolesis7.
En cuanto a las pruebas de laboratorio los hallazgos son totalmente inespecíficos, aunque es frecuente encontrar alteraciones como leucocitosis, anemia normocítica normocrómica, hipergammaglobulinemia, aumento de ferritina y aumento de VSG. Con menos frecuencia, también podemos encontrarnos factor reumatoide positivo, anticuerpos antinucleares positivos o inversión del cociente CD4/CD88.
Las pruebas de imagen pueden ser útiles en el diagnóstico diferencial, pero no son patognomónicas. En las imágenes de RM de pacientes afectos, las lesiones son isointensas en T1 y T2 e hiperintensas con gadolinio, mientras que las imágenes de tomografía computarizada son hiperdensas. La ecografía también puede ser útil, especialmente en la afectación del cuello, para ver las características de las adenopatías, así como su seguimiento8,9.
Estudio de extensión
Tras el diagnóstico de la enfermedad se recomienda la realización de un estudio de extensión, ante la posibilidad de afectación de múltiples órganos, en ocasiones sin síntomas asociados. Existen discrepancias con respecto a cuál es la prueba de imagen indicada para realizar este estudio de extensión. Por un lado, la RM tiene las ventajas de ser una prueba específica y no radiar a los pacientes, pero solo nos aporta una imagen anatómica, es poco sensible y no sirve para monitorizar la respuesta terapéutica. En cambio, la tomografía por emisión de positrones-tomografía computarizada (PET-TC) nos aporta una imagen anatómica y funcional al mismo tiempo, es más sensible y nos monitoriza la respuesta terapéutica, pero es menos específica que la RM y radia al paciente. En los últimos años ha habido una tendencia mayor a la utilización de la PET-TC. No obstante, ambas técnicas son válidas para el estudio de extensión y la elección de una u otra deberá hacerse de manera individualizada dependiendo de varios factores como la experiencia del médico, las posibilidades del hospital y del propio paciente9,10.
Tratamiento
Hoy en día no existe consenso sobre el tratamiento de esta enfermedad. Más de la mitad de los pacientes afectos de ERD tienen un curso benigno no siendo necesario iniciar tratamiento.
Las indicaciones para iniciar tratamiento serían la existencia de afectación extranodal con compromiso de órganos vitales o la afectación nodal con complicaciones asociadas.
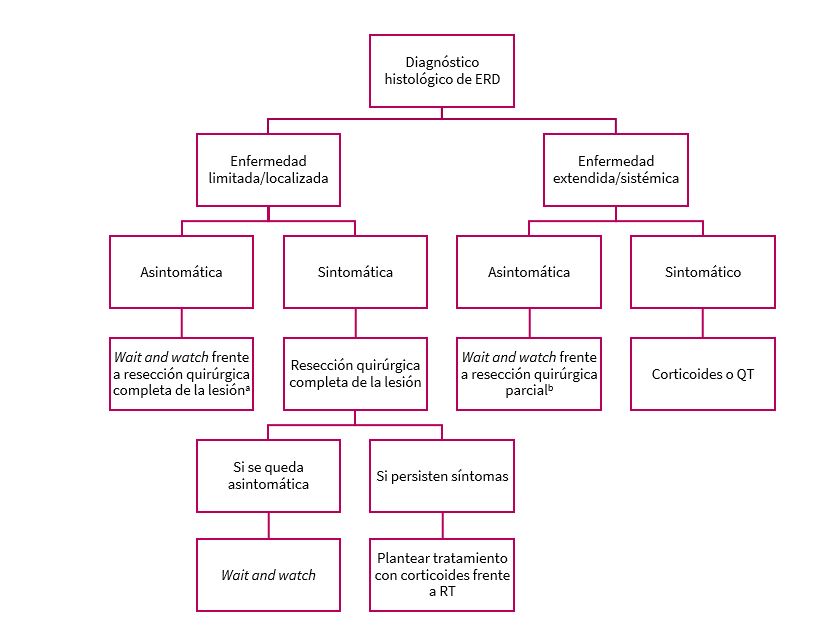
Los tratamientos disponibles son muy diversos e incluyen la observación y seguimiento del paciente (wait and watch), corticoterapia, cirugía, radioterapia y quimioterapia.
En los casos de ERD leve, con la observación y seguimiento (wait and watch) del paciente sería suficiente. En el caso de asociar síntomas sistémicos o adenopatías masivas súbitas podría ensayarse con corticoterapia a dosis bajas. En casos más graves con compromiso de órganos vitales o limitación importante se pueden hacer distintas estrategias en función del paciente, pero generalmente se recomienda realizar cirugía, si hay una lesión grande susceptible de la misma, asociada a tratamiento con corticoides a dosis altas o, en casos extraordinarios, radioterapia (en Pediatría no suele recurrirse a la misma por la alta incidencia de efectos adversos a medio y largo plazo). Por último, en casos recidivantes o refractarios a otros tratamientos puede optarse por tratamiento quimioterápico7,10.
En la Figura 2 se refleja el algoritmo terapéutico a seguir en caso de ERD.
Figura 2. Algoritmo terapéutico de enfermedad Rosai Dorfman. Mostrar/ocultar
Pronóstico
Se trata de una enfermedad con un curso clínico impredecible, aunque normalmente es autolimitada y tiene buen pronóstico. La mortalidad global oscila entre un 5-11% según las series.
Se recomienda un seguimiento estrecho durante los primeros 2 años tras el diagnóstico. En el caso de pacientes con afectación extranodal que precise tratamiento quimioterápico, la prueba de elección para valorar la respuesta terapéutica al mismo será el PET-18 FDG. Si el paciente está asintomático y se decide no iniciar ningún tratamiento, con un seguimiento clínico en consulta será suficiente. No obstante, el seguimiento deberá ser individualizado en función de la situación clínica de cada paciente4,10.
Manejo desde Atención Primaria
Es importante realizar un correcto diagnóstico diferencial desde el centro de salud. Ante la persistencia de una adenopatía, a pesar de que no exista ninguna otra clínica acompañante, se debe realizar una anamnesis y exploración física exhaustiva, acompañadas de un estudio diagnóstico básico consistente en analítica sanguínea completa con hemograma, frotis de sangre periférica, bioquímica con función renal y hepática, marcadores inflamatorios e infecciosos y serología básica; prueba de la tuberculina; y ecografía de la lesión, lo cual nos permitirá enfocar mucho el diagnóstico y descartar las principales etiologías. Si, a pesar de ello, no encontramos una causa justificada, deberá derivarse a la consulta de Cirugía o Infectología Pediátrica del hospital de referencia para realización de biopsia, lo que nos permitirá diagnosticar al paciente casi en todos los casos.
BIBLIOGRAFÍA
- Ramadas AA, José R, Varma B, Chandy ML. Cervical lymphadenopathy: Unwinding the hidden truth. Dent Res J. 2017;14:73-8.
- Jackson MA, Day JC. Lymphatic system and generalized lymphadenopathy. En: Long S, Prober C, Fisher M (eds.). Principles and Practice of Pediatric Infectious Diseases. Elsevier; 2012
- Cai Y, Shi Z, Bai Y. Review of Rosai-Dorfman Disease: New insights into the pathogenesis of this rare disorder. Acta Haematol. 2017;138:14-23.
- Galicier L, Boutboul D, Oksenhendler E, Fieschi C, Meignin V. Histiocytose sinusale de Rosai-Dorfman. Presse Med. 2016;46:107-16.
- Lai KL, Abdullah V, Ng KS, Fung NS, van Hasselt CA. Rosai-Dorfman Disease: Presentation, diagnosis and treatment. Head Neck. 2013;35:E85-8.
- Peña Hernández A, Valladares Álvarez JR, Hernández Maldonado I, García Espinosa MO, Vásquez Guevara JD, Flores Oseguera J. Extranodal Rosai-Dorfman disease with cutaneous involvement: report of a case. iMedPub Journals. 2016;12:1-5.
- Dalia S, Sagatys E, Sokol L, Kubal T. Rosai-Dorfman Disease: Tumor Biology, Clinical Features, Pathology and Treatment. Cancer Control. 2014;21:322-7.
- Heng X, Cheng JL, Gao AK. A Study on Clinical Characteristics and Magnetic Resonance Imaging Manifestations on Systemic Rosai-Dorfman Disease. Chin Med J (Engl). 2018;131:440-447.
- Xu Q, Fu L, Liu C. Multimodality imaging-based evaluation of Rosai-Dorfman disease in the head and neck. A retrospective observational study. Medicine (Baltimore). 2017;96:e9372.
- Averitt AW, Heym K, Akers L, Castro-Silva F, Ray A. Sinus Histiocytosis With Massive Lymphadenopathy (Rosai Dorfman Disease): Diagnosis and Treatment Modalities for this Rare Entity Revisited. J Pediatr Hematol Oncol. 2018;40:e198-e202.