Pruebas diagnósticas de SARS-CoV-2
2 CS Valdelasfuentes. Alcobendas. Madrid. (España).
INTRODUCCIÓN
Los coronavirus son patógenos humanos y animales. A finales de 2019, se identificó un nuevo coronavirus como causante de un brote de casos de neumonía en Wuhan, una ciudad en la provincia de Hubei de China. Rápidamente se extendió, dando lugar a una epidemia en toda China seguida de un número creciente de casos en otros países de todo el mundo. En febrero de 2020 la Organización Mundial de la Salud (OMS) designó a la enfermedad como COVID-19 o enfermedad por coronavirus 2019 y al virus causante coronavirus 2 del síndrome respiratorio agudo grave o SARS-CoV-2. El 11 de marzo de 2020, debido a la extensión y la gravedad de la COVID-19, fue declarada pandemia por la OMS.
Los síntomas pueden ser inespecíficos e indistinguibles de las infecciones producidas por otros virus, por lo que son necesarias las pruebas diagnósticas microbiológicas, siempre que estén disponibles, tanto para el manejo de la enfermedad individual como de la actual pandemia. Esto posibilita un mejor manejo (aislamiento y tratamiento si fuera necesario) y monitorización de los pacientes, la aplicación de medidas de prevención y control de la expansión y la vigilancia epidemiológica1.
Determinar la población diana a quién realizar las pruebas diagnósticas responde tanto a criterios clínicos como epidemiológicos (control de la transmisión)2:
- Personas con síntomas sospechosos de COVID-19 residentes o que hayan viajado en los 14 días previos a zonas de transmisión comunitaria, en particular si ha habido relación con brotes o personas pertenecientes a ámbitos comunitarios.
-
Personas asintomáticas:
- Contactos desde 2 días antes del inicio de los síntomas hasta el momento del aislamiento de casos confirmados.
- Detección rápida de la infección en grupos de convivencia en instalaciones cerradas o semicerradas de personas con riesgo de enfermedad grave (centros sociosanitarios): realización de pruebas tanto en respuesta a casos o brotes de COVID-19 como cribado periódico en empleados y residentes.
- Despistaje en algunas actuaciones asistenciales: pacientes que van a ser hospitalizados en lugares de prevalencia elevada, antes de procedimientos quirúrgicos (urgentes o programados) o procedimientos que generan aerosoles, antes de realizar determinadas pruebas diagnósticas y antes de recibir terapia inmunosupresora (incluyendo previa a trasplantes).
- No se recomienda repetir las pruebas a individuos asintomáticos previamente diagnosticados de infección por SARS-CoV-2 en los 3 meses previos, debido a que un resultado positivo en este periodo probablemente no se deba a una nueva infección activa.
En caso de disponibilidad limitada de pruebas diagnósticas los grupos prioritarios para su realización serían: pacientes hospitalizados (especialmente enfermos críticos con enfermedad respiratoria no filiada) y personas asintomáticas que sean trabajadores sanitarios o en primera línea de respuesta, trabajadores y residentes en ámbitos comunitarios y personas con factores de riesgo de enfermedad grave3.
Hay que tener en cuenta que la positividad en una prueba de SARS-CoV-2 no descarta la infección por otros patógenos y viceversa, ya que se han descrito coinfecciones, aunque no se conoce mucho su papel3.
¿DE QUÉ PRUEBAS DISPONEMOS PARA EL DIAGNÓSTICO DE INFECCIÓN POR SARS-COV-2?
Hay tres tipos de pruebas diagnósticas de SARS-CoV-21-3:
- Pruebas o técnicas de detección y amplificación de ácidos nucleicos (TAAN): la más usada es reacción en cadena de la polimerasa (PCR). Es la prueba diagnóstica de infección activa (PDIA) por SARS-CoV-2 de referencia.
- Pruebas de detección de antígeno. En la actualidad se aceptan como PDIA de SARS-CoV-2.
- Pruebas de detección de anticuerpos. No se aceptan como PDIA de SARS-CoV-2. Sirven para detectar infección en resolución o pasada.
Las pruebas de cultivo del virus no se realizan de rutina en los laboratorios por razones de seguridad (elevado riesgo de contagio), sino fundamentalmente con fines de investigación.
En la Tabla 1 se resumen de forma comparativa las pruebas diagnósticas disponibles según sus indicaciones de uso, rendimiento y otros aspectos.
Tabla 1. Comparación de las técnicas diagnósticas de SARS-CoV-2. Mostrar/ocultar
PRUEBAS DE DETECCIÓN DE ÁCIDOS NUCLEICOS: REACCIÓN EN CADENA DE LA POLIMERASA (PCR)
¿Qué detectan?
Las TAAN o técnicas moleculares sirven para la detección y amplificación de material genético, ARN, del SARS-CoV-2, en distintas muestras biológicas clínicas. La prueba más usada es la reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR o qRT-PCR si es cuantificada en tiempo real).
Hay otros métodos de amplificación/detección de ácidos nucleicos potencialmente útiles que se encuentran en desarrollo o en proceso de ser comercializados: con diana en las clustered regularly interspaced short palindromic repeats (CRISPR) o repeticiones palindrómicas cortas agrupadas y regularmente espaciadas; técnicas de amplificación de ácidos nucleicos isotérmicas (por ejemplo, reverse transcription loop-mediated isothermal amplification [RT-LAMP]); ensayos de microarrays moleculares y técnicas de secuenciación de nueva generación2,3
¿En qué muestras se realiza?
Las muestras respiratorias son las más idóneas para el diagnóstico de infección por SARS-CoV-2. Se han obtenido resultados positivos de la RT-PCR para SARS-CoV-2 en muestras no respiratorias: orina, heces, incluso en sangre, pero no hay datos hasta la fecha de transmisión por heces u orina y el riesgo de transmisión hemática se considera bajo.
Las muestras de vías respiratorias altas son la primera elección en las fases iniciales de la infección, sobre todo en casos leves o asintomáticos3. Algunos estudios han encontrado que las muestras de hisopado nasofaríngeo ofrecen mejor rendimiento que las de hisopado orofaríngeo3. La combinación de hisopados nasofaríngeo y orofaríngeo del mismo individuo aumenta la sensibilidad y mejora la fiabilidad de los resultados. Las muestras pueden ser combinando dos hisopos, orofaríngeo y nasofaríngeo en el mismo tubo, o ambas muestras, orofaríngea y nasofaríngea, en un único hisopo3.
En EE. UU., los Centros para el Control y Prevención de Enfermedades (CDC) aceptan como posibles muestras de vías respiratorias altas alguna de las siguientes4:
- Hisopado nasofaríngeo (recogido por personal sanitario).
- Hisopado orofaríngeo (recogido por personal sanitario).
- Hisopado anterior de las fosas nasales (recogido por un profesional sanitario o el paciente con un hisopo de poliéster hilado o flocado).
- Hisopado nasal de los cornetes medios (recogido por personal sanitario o por el paciente en un lugar supervisado con un hisopo cónico flocado).
- Lavado/aspirado nasal o nasofaríngeo (realizado por un profesional sanitario).
- Saliva, 1-5 ml (recogida por el propio paciente de forma supervisada).
En muestras de vías respiratorias bajas, el ARN viral aumenta durante la segunda semana de la enfermedad y se puede encontrar positividad hasta al cabo de tres semanas desde el inicio de los síntomas, por lo que la probabilidad de positividad de la prueba es mayor2. Estas muestras están indicadas en un curso más avanzado de la enfermedad en pacientes con negatividad previa en las muestras de vías respiratorias altas y elevada sospecha3. Pueden ser de esputo producido espontáneamente (no se recomienda el esputo inducido por el riesgo elevado de transmisión por aerosoles) o aspirado endotraqueal o lavado broncoalveolar (pacientes intubados). Existe un elevado riesgo de aerosolización, por lo que la recogida de muestras debe realizarse cumpliendo las estrictas medidas de prevención y control de la infección3.
Las muestras autorrecogidas (recogidas por el propio paciente) tienen las ventajas de evitar la exposición del personal sanitario y reducir la necesidad de equipos de protección individual3. La precisión parece ser relativamente buena con algunas de estas muestras (hisopados nasales y muestras de saliva). Algunos estudios han encontrado una sensibilidad similar entre muestras nasales o de cornetes medios autorrecogidas y en muestras nasofaríngeas recogidas por personal sanitario2.
Las muestras agrupadas para TAAN o pooled testing (realización de pruebas a varias muestras juntas y solamente repetir las muestras individuales si la muestra agrupada resulta positiva) pueden servir para mejorar la capacidad de procesar las muestras por el laboratorio2,3. Puede ser útil en poblaciones en las que se sospeche baja prevalencia, como en asintomáticos sin exposición conocida. Se debe tener en cuenta que agrupar las muestras reduce la sensibilidad de la prueba (en mayor medida cuanto mayor sea el grupo de muestras) y puede retrasar el tiempo para un resultado positivo individual2.
Para no perder precisión en el diagnóstico es necesario que todos los pasos del proceso de las muestras (recogida, transporte, almacenamiento y procesamiento) sean correctos y que el personal sanitario encargado de realizar cada uno reciba un entrenamiento y formación continuados1.
Técnica de realización de la RT-PCR
La RT-PCR se realiza en laboratorios de Microbiología Clínica, necesita personal experto en microbiología molecular y medidas de bioseguridad. La muestra debe ser en primer lugar inactivada. La PCR es una técnica utilizada para amplificar secuencias de ADN. Consta de dos fases: extracción y amplificación de los ácidos nucleicos. El ARN es monocatenario y muy inestable por lo que primero debe transcribirse de forma inversa en ADN complementario (ADNc) utilizando una transcriptasa inversa. A partir de aquí, se utiliza el procedimiento de PCR convencional para amplificar el ADNc. Se utilizan secuencias cortas de ADNc, cebadores o primers, para seleccionar la parte del genoma a amplificar. En los termocicladores, la temperatura de la muestra se sube y se baja repetidamente para ayudar a la ADN polimerasa a duplicar la secuencia del ADN que está siendo copiada. Con esta técnica se producen millones de copias de la secuencia estudiada en unas horas. Lo ideal es que ambos procesos estén automatizados para aumentar la rapidez y evitar errores. En la actualidad el resultado de las pruebas está disponible en unas horas (si bien el tiempo entre la solicitud de la prueba y su resultado puede variar desde 4-6 horas a varios días por demoras en la extracción de la muestra, transporte, elevado número de muestras en los laboratorios, etc.). Otra ventaja de la PCR es que permite procesar simultáneamente un elevado número de muestras1.
Los genes diana más usados para la detección de SARS-CoV-2 son el gen E (recomendado por la OMS como cribado de primera línea), y los genes RdRp, N, S y Orf1ab. Para el diagnóstico de confirmación en zonas sin circulación del virus SARS-CoV-2 se necesita la positividad frente a dos genes distintos, uno de ellos específico del mismo, o positividad frente a un betacoronavirus más una identificación al menos parcial del genoma del virus SARS-CoV-2. En zonas de transmisión comunitaria se considera suficiente la positividad de la RT-PCR para un único gen que sea discriminatorio de COVID-191.
¿Cuándo debe realizarse la prueba?
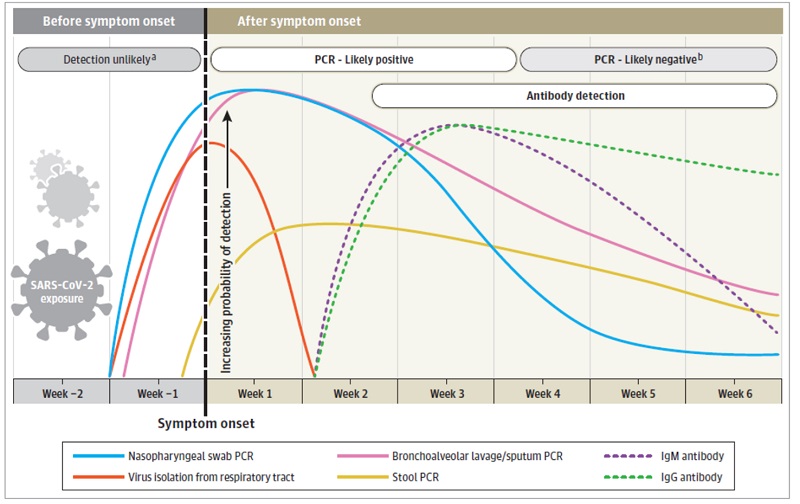
El periodo de incubación del SARS-CoV-2 en los pacientes sintomáticos son unos 5-6 días, con un rango entre 1-14 días tras la exposición. La carga viral en nariz y faringe va ascendiendo desde el momento de la infección (inicio del periodo de incubación) siendo máximo alrededor de la semana de la infección, coincidiendo con los 2-3 días previos y los 1-2 primeros días del inicio de los síntomas. A partir de ese momento va disminuyendo, con una persistencia variable en las vías respiratorias3. Por ello, el mejor momento para realizar la prueba es el primer o segundo día tras el inicio de los síntomas y, en cualquier caso, en la primera semana3,5,6 (Figura 1).
Figura 1. Variación en el tiempo estimada en las pruebas diagnósticas de SARS-CoV-2 relacionadas con el inicio de los síntomas6. Mostrar/ocultar
En los pacientes asintomáticos los datos sobre el rendimiento de las pruebas son limitados, ya que no están claros los niveles de ARN viral tras la exposición ni cuál es el momento en que es detectable. Se recomienda a los 5-7 días tras la exposición basado en la media del periodo de incubación2.
¿Qué especificidad y sensibilidad tiene? ¿Cómo debe interpretarse?
Es la prueba más sensible de los métodos disponibles, por lo que es la técnica de referencia y de elección para el diagnóstico de COVID-19.
La precisión y los valores predictivos de las TAAN no se han evaluado sistemáticamente. Los falsos positivos son raros2. Los falsos negativos informados varían entre menos de 5% al 40%, aunque estas estimaciones son limitadas, ya que no existe un estándar de referencia perfecto para la comparación2.
La sensibilidad de la PCR depende del tipo y calidad de la muestra, del momento de la enfermedad y del ensayo específico utilizado.
Con respecto al tipo de ensayo, hay diferencias en el límite de detección entre los principales ensayos comerciales. El umbral de ciclo (Ct) se refiere al número de ciclos en un ensayo de RT-PCR necesario para amplificar el ARN viral para alcanzar un nivel detectable. El Ct por lo tanto, indica el nivel de ARN viral en una muestra, de manera que valores de Ct bajos reflejan niveles elevados de ARN viral y viceversa. Los laboratorios generalmente no proporcionan el valor de Ct, sino un resultado cualitativo. Al no estar los valores de Ct estandarizados en las plataformas de RT-PCR, los resultados de distintas pruebas no se pueden comparar, por lo que su aplicación clínica no está clara. Además, no se ha validado el uso de Ct para guiar el manejo clínico o epidemiológico en ningún estudio2.
Un único resultado negativo en una prueba de PCR, especialmente si se ha realizado a partir de una muestra de las vías respiratorias superiores, no excluye la posibilidad de una infección por SARS-CoV-2. Se recomienda repetir el muestreo, o con una muestra de las vías respiratorias inferiores en caso de enfermedad grave o progresiva.
Se deben interpretar con cautela los resultados positivos débiles, ya que algunos ensayos producen señales falsas con valores altos de Ct. Si el resultado es inválido o cuestionable, se debe obtener una nueva muestra del paciente y realizar una nueva prueba3.
Un resultado indeterminado puede indicar que solo se ha identificado uno de los dos o más genes a los que se dirige la prueba TAAN. Dada su alta especificidad, estos resultados pueden considerarse presuntos positivos. Si el paciente se encuentra en una etapa temprana de la enfermedad, se puede repetir la prueba para confirmar2.
Pueden aparecer falsos negativos1,3 si la muestra es inadecuada (cantidad escasa), el transporte es inadecuado (no se mantiene la cadena de frío) o con retraso, errores preanalíticos (mal etiquetado), poca eliminación de virus por el paciente por el estadio del proceso (asintomático, presintomático o postsintomático) o por la gravedad de este o por razones técnicas inherentes a la prueba (ej. inhibición de la PCR o mutación del virus).
Existe la posibilidad de falsos positivos1,3 si hay errores preanalíticos (etiquetado) o contaminación cruzada entre muestras durante el procesamiento.
PCR persistente o recurrente durante la convalecencia
El ARN viral de SARS-CoV-2 puede ser detectable desde solo unos días a semanas o incluso meses tras el inicio de los síntomas. También se han documentado resultados positivos recurrentes de PCR tras varios resultados negativos en algunos pacientes de COVID-19. Sin embargo, la detección prolongada o recurrente de ARN viral no indica necesariamente infectividad prolongada. Raramente se han aislado virus con capacidad infectiva en muestras de vías respiratorias altas al cabo de más de 10 días tras el inicio de los síntomas en pacientes con infección no grave y cuyos síntomas se han resuelto2. Además, los niveles de ARN durante la convalecencia, en caso de ser detectables, son más bajos que los detectados durante la enfermedad aguda, y por debajo de un cierto umbral viral no se detectarían virus con capacidad infectiva. Ante hallazgos positivos persistentes de PCR se considera que existe una menor probabilidad de infectividad: 1) a mayor número de días transcurridos desde la resolución de los síntomas; 2) con carga viral baja en las secreciones respiratorias, y 3) si hay presencia de anticuerpos neutralizantes3.
Si bien se han documentado casos esporádicos de reinfección por SARS-CoV-2 tras una COVID-19 previa, realizar el diagnóstico de reinfección es un reto y no se puede hacer exclusivamente con la PCR. Las características que aumentan la probabilidad de reinfección en estos casos serían: un intervalo prolongado de tiempo desde la primera infección, un nivel elevado de ARN viral en la prueba repetida y anticuerpos IgG indetectables en el momento en que se considera la reinfección. Sin embargo, la reinfección solo puede confirmarse mediante secuenciación genómica, para establecer que las infecciones fueron causadas por dos virus diferentes. Para la mayoría de los pacientes, no se suele disponer de secuenciación genómica ni de una muestra de la infección inicial. En estos casos, es apropiado tratar a los pacientes que cumplen los criterios clínicos como si tuvieran una presunta reinfección4.
Prueba rápida de PCR
En la actualidad se han desarrollado sistemas rápidos de PCR (point-of-care), aunque algunos son menos sensibles que los test de laboratorio2 (sensibilidad entre 68% y 100%), con una media de sensibilidad del 95,2% y especificidad del 98%7.
PRUEBAS DE DETECCIÓN DE ANTÍGENOS
Ante la creciente necesidad de pruebas más rápidas, sencillas y económicas que las técnicas moleculares, múltiples casas comerciales han desarrollado diferentes pruebas rápidas de detección de antígenos (PRDA). Las primeras que estuvieron disponibles al inicio de la pandemia no se aconsejaron por la baja y variable sensibilidad que presentaban. Actualmente existen pruebas con mayor sensibilidad, si bien la variabilidad entre ellas y comparado con las TAAN sigue siendo muy alta, oscilando entre 0-94%, con una sensibilidad media de 56.2%, según una revisión sistemática reciente7. A pesar de ello, de la falta de más estudios independientes y rigurosos y de que la mayoría no están aprobadas por entidades reguladoras (FDA, EUA, CE), la OMS apoya su uso en determinadas situaciones aconsejando que cumplan ciertos mínimos como que la sensibilidad sea ≥80% y la especificidad ≥97%-100%8. La especificidad de las PRDA en general es comparable a las técnicas moleculares7. Su disponibilidad en España ha supuesto agilizar el diagnóstico de los casos, permitiendo un mejor control de la infección, y disminuir la presión sobre los laboratorios de microbiología, cuya demora en ofrecer los resultados de la PCR en algunos casos la hacía poco útil para dicho control.
¿En qué consiste? ¿Qué sensibilidad y especificidad tienen?
Las PRDA se basan en la detección de proteínas virales específicas de SARS-CoV-2, como la proteína N de nucleocápside y las subunidades S1 o S2 de la proteína S (spike, espiga).
Las técnicas que se emplean mayoritariamente en las PRDA para SARS-CoV-2 son la inmunocromatografía (ICT) y la inmunofluorescencia (IF). Son técnicas cualitativas (resultado positivo/negativo) y son ampliamente utilizadas para el diagnóstico de otras infecciones como la faringoamigdalitis por Streptococcus pyogenes o la gripe. Una de las mayores ventajas es que se obtienen los resultados en menos de 30 minutos. Las pruebas de ICT se leen directamente, por el profesional que realiza la prueba, con la consiguiente posibilidad de variabilidad interpersonal, sobre todo en los casos positivos débiles. Las pruebas de IF precisan un instrumento de lectura, siendo a cambio más precisas, al ser la lectura estandarizada.
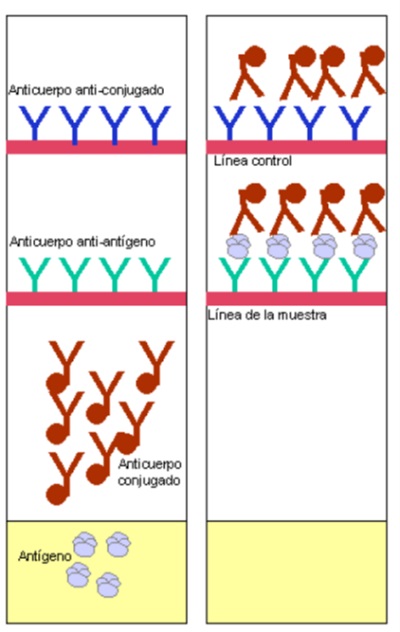
Figura 2. Inmunocromatografía. Sobre una membrana de nitrocelulosa se encuentran absorbidos en la línea de reacción anticuerpos contra el antígeno que buscamos y sobre la línea de control anticuerpos anticonjugado. Cuando la muestra del paciente contiene antígeno este queda retenido en la línea de reacción. El conjugado, que también es un anticuerpo específico frente al antígeno que buscamos, está marcado con una molécula de oro coloidal, que también fluye por la membrana, es retenido por el antígeno en la línea de reacción y por el anticuerpo en la línea control. En el caso de muestras negativas que no contienen antígeno, el conjugado es retenido únicamente en la línea de control9. Mostrar/ocultar
En cuanto a la sensibilidad, como se ha mencionado anteriormente, es muy variable según estudios y marcas comerciales7. En un estudio prepublicado que analiza la PDRA de la que disponemos actualmente en España, PanbioTM COVID-19 Ag Rapid Test, en 412 pacientes sintomáticos, incluyendo niños, atendidos en Atención Primaria encontraron una sensibilidad de 79.6% y una especificidad de 100% comparado con RT-PCR como técnica de referencia10.
¿Cómo y cuándo debe realizarse la prueba?
La muestra se obtiene del tracto respiratorio, generalmente de exudado nasofaríngeo u orofaríngeo o de saliva y requiere una correcta recogida en el momento adecuado, como ocurre con la PCR. La positividad de la prueba está correlacionada con la carga viral8. Según Hirotsu et al., con cargas virales de >2 log copias/ml hay una concordancia entre prueba antigénica y técnica molecular del 100%, con 1-2 log copias/ml baja a un 66% y <1 log copias/ml hasta un 33%11. Dado que se considera que la carga viral es más elevada en nasofaringe y saliva y más alta en la fase aguda de la infección (desde 2-3 días antes de iniciar los síntomas y los primeros 7 días del inicio de la sintomatología)6,12 se recomienda realizar la prueba preferentemente en los 5 primeros días y en cualquier caso antes de los 7 días del comienzo de la clínica. En España la PRDA que más se está usando en Atención Primaria está basado en la ICT y la muestra se obtiene de la nasofaringe.
Interpretación de la prueba e indicaciones
Como cualquier prueba diagnóstica, no solo es importante la sensibilidad y la especificidad, sino también el contexto y la prevalencia de la infección en esa área y las características clínico-epidemiológicas que hacen que un paciente tenga una probabilidad preprueba más o menos alta. En situaciones en las que el paciente tiene mayor probabilidad de presentar la infección (prevalencia alta, transmisión comunitaria, contacto con casos confirmados, clínica compatible con COVID-19) si se utiliza una prueba sensible, el valor predictivo positivo será alto, por lo que un resultado positivo indicaría mayor probabilidad de que sea una infección COVID-19. Por el contrario, ante un resultado negativo sería necesario confirmarlo con una prueba molecular dado que en esos escenarios el valor predictivo negativo sería bajo. En situaciones en las que hay baja sospecha de infección la probabilidad pre-prueba es baja, si se obtiene un resultado negativo se podría descartar la infección de forma razonable8,13. En la Tabla 2 se muestra la relación entre la probabilidad preprueba y los valores predictivos positivo y negativo, a tener en cuenta para la interpretación de los resultados.
Tabla 2. Valores predictivos positivo y negativo e impacto en los resultados según la probabilidad preprueba13. Mostrar/ocultar
Teniendo en cuenta estos factores, en un paciente en el que, por las características clínico-epidemiológicas, se sospeche una infección por SARS-CoV-2, dado que la detección del antígeno viral implica replicación activa del virus, un resultado positivo de la prueba indicaría infección activa por SARS-CoV-2.
Hay posibilidad de falsos negativos si8,13:
- Carga viral insuficiente del paciente en el momento de realización de la prueba.
- Sensibilidad insuficiente de la prueba.
- Técnica de recogida inadecuada; transporte inadecuado.
Hay que tener en cuenta además la diana antigénica ya que algunas proteínas virales se producen en mayores concentraciones (por ejemplo: la proteína N en comparación con la S).
Pueden aparecer falsos positivos8,13 si hay reactividad cruzada con otros coronavirus humanos.
Actualmente la principal indicación de las PDRA es la detección de infección activa en personas con síntomas compatibles (en los 5-7 primeros días desde el comienzo de la clínica) en países o áreas con alta transmisión comunitaria donde el sistema sanitario está sobrecargado y no haya posibilidad de realizar TAAN a todos los casos sospechosos. Se puede considerar su utilización en pacientes asintomáticos contactos de casos, ya que las cargas virales son similares en sintomáticos y asintomáticos, aunque no están específicamente autorizados para este uso. Tampoco se recomienda su empleo para estudios de cribado salvo circunstancias determinadas8.
PRUEBAS DE DETECCIÓN DE ANTICUERPOS: DIAGNÓSTICO SEROLÓGICO
¿En qué consisten? ¿Qué sensibilidad y especificidad tienen?
Las pruebas serológicas consisten en la detección de anticuerpos antivirales específicos IgM, IgG, IgA o inmunoglobulinas (Ig) totales en una muestra de plasma o suero. Existen diferentes técnicas para la detección de anticuerpos y se pueden clasificar en14:
- Pruebas rápidas (point-of-care tests): la mayoría están basadas en la ICT.
- Pruebas de laboratorio: ensayos por inmunoabsorción ligado a enzimas (ELISA) (Figura 3) o inmunoensayos quimioluminiscentes (CLIA). Estas son más sensibles que las pruebas rápidas.
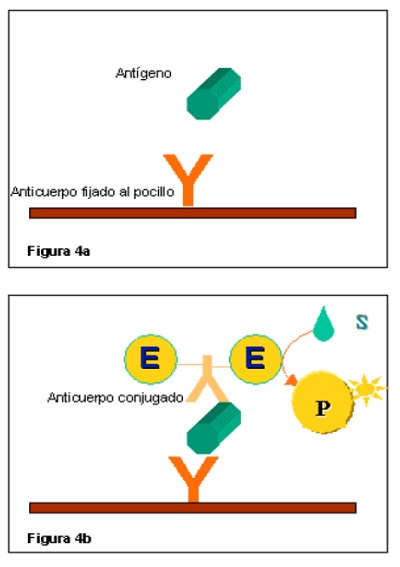
Figura 3. Enzimoinmunoanálisis (ELISA). Existen cuatro tipos de ELISA: directo, indirecto, tipo sándwich y competitivo. Generalmente los anticuerpos específicos están fijados sobre la superficie de pocillos en placas de poliestireno y retienen a los antígenos presentes en la muestra. Se usan anticuerpos específicos del antígeno marcados con enzimas y se produce un cambio de color al interaccionar con el sustrato específico9. Mostrar/ocultar
Tanto las pruebas rápidas como las de laboratorio pueden detectar las IgG e IgM, e incluso IgA, por separado o Ig totales en suero, plasma o sangre entera, aunque hay pruebas de ICT para muestras de saliva.
Estas técnicas, como las pruebas de detección de antígenos, se fundamentan en la afinidad antígeno-anticuerpo y como diana antigénica se usan mayoritariamente la proteína S y la proteína N. La diana antigénica determina la reactividad cruzada y especificidad ya que la N está más conservada en los coronavirus que la S y dentro de la proteína S, la proteína de unión al receptor (receptor-binding protein [RBD]) está más conservada que la subunidad S1 o la proteína S completa14.
Por último, también se están desarrollando pruebas de detección de anticuerpos neutralizantes, aunque no están autorizadas por el momento. Los anticuerpos neutralizantes son un subtipo de anticuerpos que bloquean la entrada del virus en la célula huésped e impiden el progreso de la infección.
En cuanto a la sensibilidad y especificidad de las pruebas serológicas comercializadas son variables y los estudios independientes aún son insuficientes, pero hay pruebas disponibles con especificidad cercana al 100%6,14. A pesar de ello la mayoría coinciden en que: 1. su sensibilidad máxima se alcanza a partir de la 2ª-3ª semana tras inicio de los síntomas y 2. la especificidad suele ser alta, dependiendo de las dianas antigénicas utilizadas3. Para disminuir el riesgo de falsos positivos, se requiere una prueba altamente específica y testar pacientes con una alta probabilidad de que hayan estado expuestos al virus (probabilidad de pre-prueba alta).
En el siguiente link se encuentra una lista de aquellas que han obtenido la EUA por la FDA y cálculos sobre el rendimiento esperado asumiendo una prevalencia del 5%: https://www.fda.gov/medical-devices/coronavirus-disease-2019-covid-19-emergency-use-authorizations-medical-devices/eua-authorized-serology-test-performance
¿Cómo y cuándo debe realizarse la prueba?
Cuando una persona inmunocompetente se infecta de SARS-CoV-2, de forma general desarrollará una respuesta inmune con elevación de anticuerpos específicos contra el virus. Las IgM se pueden detectar a partir de la primera semana aproximadamente tras el inicio de los síntomas y pasados unos 15-21 días aparecen los anticuerpos de tipo IgG6,14 (Figura 1).
Interpretación de la prueba e indicaciones
Las serologías proporcionan información sobre una infección en fase de resolución o pasada por lo que no se acepta el uso de estas pruebas para el diagnóstico de la infección aguda. Por otro lado, se desconoce aún el tiempo que los anticuerpos se mantienen detectables. Algunos pacientes no desarrollan niveles detectables de anticuerpos a pesar de haber pasado la infección, por lo que una serología negativa no descarta una infección previa. No se puede descartar tampoco la reactividad cruzada con otros coronavirus humanos por lo que puede haber falsos positivos14.
Por el momento su indicación más clara es la monitorización de la pandemia y estudiar la epidemiología. Si bien no está indicado su uso para el diagnóstico agudo, las pruebas de detección de anticuerpos podrían ser útiles para complementar el uso de la PCR en determinadas situaciones como en pacientes con sospecha clínica, pero con tiempo de evolución de más 10-14 días en los que se sabe que la sensibilidad de la PCR o pruebas de detección de antígeno va disminuyendo a la vez que va aumentando la de las pruebas de detección de anticuerpos. También se podría utilizar para casos pediátricos con sospecha de síndrome inflamatorio multisistémico pediátrico vinculado a SARS-CoV-2 (SIM-Peds) por la misma razón3,14.
Otra indicación sería la identificación y estudio de posibles donantes humanos para la obtención de suero hiperinmune y plasma de convalecientes como tratamiento en casos graves de COVID-19 y evaluación de la vacuna14.
¿Cuándo está indicada cada prueba?
Los objetivos del diagnóstico de SARS-CoV-2 son el control epidemiológico de la pandemia principalmente y el manejo clínico del paciente. Es importante tanto el conocimiento de las pruebas diagnósticas como las indicaciones específicas de cada una de ellas y su interpretación. Las indicaciones de uso y el rendimiento de cada prueba según el momento de evolución de la infección se indican en la Tabla 1 y en la Figura 1. En la Tabla 3 se resume la interpretación clínica de las pruebas diagnósticas.
Tabla 3. Interpretación clínica de las pruebas diagnósticas5. Mostrar/ocultar
BIBLIOGRAFÍA
- Onoda M, Martínez Chamorro MJ; Grupo de Patología Infecciosa de la Asociación Española de Pediatría de Atención Primaria. Pruebas diagnósticas de laboratorio de COVID-19. En: AEPap [en línea] [consultado el 18/12/2020]. Disponible en: https://aepap.org/grupos/grupo-de-Patologiainfecciosa/contenido/documentos-delgpi
- Caliendo AM, Hanson KE. Coronavirus disease 2019 (COVID-19): Diagnosis. En: UpToDate [en línea] [consultado el 18/12/2020]. Disponible en: https://www.uptodate.com
- Diagnostic testing for SARS-CoV-2: interim guidance, 11 September 2020. En: Organización Mundial de la Salud [en línea] [consultado el 18/12/2020]. Disponible en: https://apps.who.int/iris/handle/10665/334254
- Interim Guidelines for Collecting, Handling, and Testing Clinical Specimens from Persons Under Investigation (PUIs) for Coronavirus Disease 2019 (COVID-19). En: Centers for Disease Control and Prevention [en línea] [consultado el 18/12/2020]. Disponible en: https://www.cdc.gov/coronavirus/2019-nCoV/lab/guidelines-clinical-specimens.html
- Interpretación de las pruebas diagnósticas frente a SARS-CoV-2. En: Ministerio de Sanidad [en línea] [consultado el 18/12/2020]. Disponible en: https://www.mscbs.gob.es/profesionales/saludPublica/ccayes/alertasActual/nCov/documentos/INTERPRETACION_DE_LAS_PRUEBAS.pdf
- Sethuraman N, Jeremiah SS, Ryo A. Interpreting Diagnostic Tests for SARS-CoV-2. JAMA. 2020;323:2249-51.
- Dinnes J, Deeks JJ, Adriano A, Berhane S, Davenport C, Dittrich S, et al. Rapid, point-of-care antigen and molecular-based tests for diagnosis of SARS-CoV-2 infection. Cochrane Database Syst Rev. 2020;8:CD013705.
- Antigen-detection in the diagnosis of SARS-CoV-2 infection using rapid immunoassays: interim guidance, 11 September 2020. En: Organización Mundial de la Salud [en línea] [consultado el 18/12/2020]. Disponible en: https://www.who.int/publications/i/item/antigen-detection-in-the-diagnosis-of-sars-cov-2infection-using-rapid-immunoassays
- Domínguez J, Alonso C, Bartolomé R, Matas L, Rabella N. Técnicas rápidas de detección de antígeno. En: Sociedad Española de Enfermedades Infecciosas y Microbiología y Clínica [en línea] [consultado el 18/12/2020]. Disponible en: https://seimc.org/contenidos/documentoscientificos/procedimientosmicrobiologia/seimc-procedimientomicrobiologia19.pdf
- Albert E, Torres I, Bueno F, Huntley D, Molla E, Fernández-Fuentes MA, et al. Field evaluation of a rapid antigen test (Panbio™ COVID-19 Ag Rapid Test Device) for the diagnosis of COVID-19 in primary healthcare centers. MedRxiv [Internet].2020. Doi: https://doi.org/10.1101/2020.10.16.20213850
- Hirotsu Y, Maejima M, Shibusawa M, Nagakubo Y, Hosaka K, Amemiya K, et al. Comparison of automated SARS-CoV-2 antigen test for COVID-19 infection with quantitative RT-PCR using 313 nasopharyngeal swabs, including from seven serially followed patients. Int J Infect Dis. 2020 Oct;99:397-402.
- He X, Lau EHY, Wu P, Deng X, Wang J, Hao X, et al. Temporal dynamics in viral shedding and transmissibility of COVID-19. Nat Med. 2020;26:672-675.
- Interim Guidance for Rapid Antigen Testing for SARS-CoV-2. En: Centers for Disease Control and Prevention [en línea] [consultado el 18/12/2020]. Disponible en: https://www.cdc.gov/coronavirus/2019-ncov/lab/resources/antigen-tests-guidelines.html
- Interim Guidelines for COVID-19 Antibody Testing. Interim Guidelines for COVID-19 Antibody Testing in Clinical and Public Health Settings. En: Centers for Disease Control and Prevention [en línea] [consultado el 18/12/2020]. Disponible en: https://www.cdc.gov/coronavirus/2019-ncov/lab/resources/antibody-tests-guidelines.html
LECTURAS RECOMENDADAS
Guía provisional de la OMS para el diagnóstico de infección por SARS-CoV-2 que actualiza la previa. Aborda la recolección de muestras, las TAAN, las pruebas de detección de antígenos y las pruebas de detección de anticuerpos.
- Diagnostic testing for SARS-CoV-2: interim guidance, 11 September 2020. En: Organización Mundial de la Salud [en línea] [consultado el 18/12/2020]. Disponible en: https://apps.who.int/iris/handle/10665/334254
Ofrece consideraciones para la integración las pruebas rápidas antigénicas en los programas de gestión de brotes de COVID-19, reconociendo que aún hay insuficientes datos sobre su rendimiento y la utilidad operativa.
- Antigen-detection in the diagnosis of SARS-CoV-2 infection using rapid immunoassays: interim guidance, 11 September 2020. En: Organización Mundial de la Salud [en línea] [consultado el 18/12/2020]. Disponible en: https://www.who.int/publications/i/item/antigen-detection-in-the-diagnosis-of-sars-cov-2infection-using-rapid-immunoassays
Resumen de recomendaciones de los CDC con respecto a las estrategias de pruebas de COVID-19 en diferentes situaciones y en diferentes entornos.
- Guidance for Healthcare Workers about COVID-19 (SARS-CoV-2) Testing Updated July 31, 2020. En: Centers for Disease Control and Prevention [en línea] [consultado el 18/12/2020]. Disponible en: https://www.cdc.gov/coronavirus/2019-ncov/hcp/testing.html