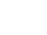Faringoamigdalitis estreptocócica en la infancia
RESUMEN
Siendo una de las más frecuentes infecciones que los pediatras afrontamos en las consultas de Atención Primaria, en la mayoría de ocasiones hacemos un manejo empírico de esta patología. Todas las guías de práctica clínica basadas en la evidencia que recomiendan tratar la faringoamigdalitis estreptocócica, consideran esencial el diagnóstico microbiológico mediante test de detección de antígeno o mediante cultivo convencional a pacientes previamente seleccionados por determinados criterios clínicos. Solamente se tratarían con antimicrobianos aquellas faringoamigdalitis confirmadas como estreptocócicas. Hay unanimidad en que el tratamiento de elección debe seguir siendo penicilina V por vía oral durante diez días, aunque amoxicilina es considerada una alternativa aceptable.
PUNTOS CLAVE
- El 20% de las consultas en pediatría de atención primaria lo son por faringoamigdalitis.
- Un 30-37% de casos de faringoamigdalitis en niños menores de 18 años serían estreptocócicas, cifra menor en menores de cuatro años (25-15%).
- Solamente precisan tratamiento antibiótico las estreptocócicas, cuyo diagnóstico ha de ser confirmado por test microbiológicos (test de detección de antígeno o cultivo).
- Se recomienda realizar pruebas diagnósticas a pacientes con unos mínimos criterios clínicos: 3-4 puntos de la escala de Centor, 3 a 5 en la de McIsaac.
- Los test rápidos de detección de antígeno son hoy una buena herramienta diagnóstica de la que debería disponerse en las consultas de Pediatría de Atención Primaria.
- El tratamiento de elección de la faringoamigdalitis estreptocócica sigue siendo penicilina V por vía oral, en dos dosis cada día y durante diez días.
- La mayoría de guías de práctica clínica consideran la amoxicilina una alternativa aceptable. En alérgicos, cefalosporinas de primera generación o macrólidos de 16 átomos de carbono serían de elección.
- Alguna guía reciente propone no tratar los casos de clínica no severa en países con baja incidencia de fiebre reumática y de complicaciones. Habrá que esperar a que se muestre como una alternativa segura y efectiva para proponerla ampliamente.
EPIDEMIOLOGÍA
La faringoamigdalitis por Streptococcus pyogenes (FAS) es una de las enfermedades bacterianas más prevalentes en la infancia y adolescencia. Muy extendida a nivel mundial, predomina en países de clima templado con picos de incidencia en invierno y primavera (en el hemisferio Norte). En España, unos 16 millones de consultas médicas anuales en toda la población serían por odinofagia en general, siendo un 20% del total de las consultas pediátricas y dando cuenta del 55% del total de prescripciones antibióticas en este grupo de edad1. Clásicamente se ha recomendado el tratamiento antibiótico de la FAS para acortar la duración de los síntomas clínicos y prevenir las complicaciones tanto supurativas como no supurativas. Con todo, múltiples publicaciones han demostrado la falta de adecuación del tratamiento antibiótico en la faringoamigdalitis, con unas tasas de uso innecesario de antibióticos excesivas. Como ejemplo, en nuestro país, un estudio multicéntrico realizado en 11 servicios de urgencias hospitalarios2, concluía que un 54,8% de prescripciones antibióticas en faringoamigdalitis en niños (0 a 18 años de edad, n = 1716) fueron inadecuadas, destacando que un 75,9% de menores de tres años había recibido tratamiento antibiótico siguiendo criterios exclusivamente empíricos.
ETIOLOGÍA
La mayoría de faringoamigdalitis son víricas, y la FAS solo supone un 10% del total de faringitis/faringoamigdalitis en los adultos y un 30% en los niños3. Un reciente metaanálisis eleva algo las cifras de prevalencia pediátrica, ya que establece que la etiología de la faringitis sería, en niños menores de 18 años, en un 37% de casos (intervalo de confianza del 95% [IC 95%]: 32 a 43) por S. pyogenes (14 estudios, n = 68 731 niños), mientras que en menores de cinco años lo sería en un 24% (IC 95%: 21 a 26; tres estudios, n = 964 niños)4, principalmente en forma de pequeñas epidemias en guarderías y centros escolares. Además, es importante considerar que S. pyogenes (o Streptococcus ß-hemoliticuss grupo A) es un colonizador habitual de la faringe sin provocar enfermedad, y en este mismo metaanálisis, se establece la prevalencia de portadores en un 12% de niños sanos (IC 95%: 9 a 14; 18 estudios, n = 9662 niños), 4% en menores de cinco años (IC 95%: 1 a 7; cuatro estudios, n = 1036 niños). Cifras similares de portadores (11,25%) en niños escolares sanos en nuestro medio, fueron confirmadas por una investigación sobre 1082 niños de Bilbao5.
El resto de faringoamigdalitis son casi siempre víricas (principalmente en menores de cuatro años de edad: Adenovirus, Rhinovirus, Coronavirus, Coxsackie, Parainfluenza, Influenza A y B, Herpes simple 1 y 2, Epstein Barr y citomegalovirus), aunque otras bacterias como Streptococcus ß-hemoliticuss de los grupos C y G, Fusobacterium necrophorum, Neisseria gonorrhoeae, Corynebacterium haemolyticus, Mycoplasma pneumonia, Arcanobacterium haemolyticum o Clhamydia pneumoniae también serían potenciales responsables de un número muy reducido de faringoamigdalitis en la infancia6.
DIAGNÓSTICO CLÍNICO
Aunque dos recientes Guías de Práctica Clínica (GPC) han recomendado no tratar la faringoamigdalitis aunque sea estreptocócica si el estado general no está afectado (NICE7, SIGN8), la mayoría de GPC basadas en la evidencia sobre faringitis/faringoamigdalitis publicadas recomiendan precisar el diagnóstico de la estreptocócica, ya que las FAS serían las únicas susceptibles de tratamiento antibiótico (ICSI9, AHA10, Alberta11, British Columbia12, Nueva Zelanda13, Finlandia14, Michigan15).
Sabemos que clínicamente hay datos a favor de que la odinofagia pueda tener una etiología estreptocócica (tabla 1), pero esta distinción no es tan clara en los niños más pequeños y, además, no todos los signos y síntomas tienen el mismo valor diagnóstico ni ninguno de ellos de forma aislada tiene valor predictivo significativo. Se han propuesto, por ello, diferentes escalas o reglas de predicción clínica (agrupan signos y síntomas) para el diagnóstico de la FAS16, pero para la edad infantil solo están validadas dos: la clásica de Centor17 y la de Centor modificada por McIsaac18.
Tabla 1. Mostrar/ocultar
En la clásica se puntúan4 ítems con 1 o 0 puntos: fiebre > 38 ºC, linfadenopatía cervical anterior, exudado amigdalar y ausencia de tos. Los cocientes de probabilidades (CP) para las puntuaciones 0, 1, 2, 3 y 4 serían, respectivamente, 0,16; 0,3; 0,5; 2,1 y 6,3. Considerando que CP < 0,2 y > 5 comenzarían a tener significativo impacto, solo las puntuaciones extremas (0 y 4) tendrían utilidad clínica para descartar o sugerir el diagnóstico.
En la modificada por McIsaac, se valoran con puntuaciones de 0 o 1 los siguientes ítems: fiebre > 38 ºC, ausencia de tos, linfadenopatía cervical anterior prominente e inflamación o exudado amigdalar, añadiendo un punto más si la edad es menor de 15 años, 0 puntos si la edad es entre 15 y 45, y restando un punto si la edad es mayor de 45. Una puntuación de –1 o 0 equivale a un CP de 0,005; con 1 punto el CP es de 0,52; para 2 puntos es de 0,95; para 3 es de 2,5; y para 4-5 es de 4,9.
Pero para darnos una idea del valor de estas reglas de predicción clínica, un estudio publicado en 200919, realizado sobre 1848 niños de 3 a 18 en EE. UU. que consultaban por faringitis, en seis consultas de Atención Primaria, mostraba que entre los niños con puntuación de McIsaac de 0 solamente un 7% tenía finalmente FAS, mientras que con 5 la tenían un 62% (tabla 2). Es decir, que en el mejor de los casos, con puntuaciones de McIsaac de 4-5, si tratamos empíricamente con antibióticos estaremos haciéndolo de forma innecesaria en aproximadamente el 50% de casos.
Tabla 2. Mostrar/ocultar
RECOMENDACIONES SOBRE EL DIAGNÓSTICO DE LA FAS
Las GPC basadas en la evidencia que recomiendan realizar pruebas diagnósticas de FAS (siete de las nueve analizadas) previas al tratamiento, lo hacen en general seleccionando previamente a los pacientes mediante criterios clínicos. Cuando las puntuaciones sean superiores a un punto de corte, se indica realizar o bien Test Rápido de Detección de Antígeno (TRDA) o bien cultivo tradicional.
Para la confirmación diagnóstica se sigue utilizando como “patrón oro” el cultivo convencional de muestra obtenida mediante hisopado de amígdala y faringe posterior. Su resultado se puede demorar hasta 48 horas, y tiene como ventajas que nos facilita poder conocer el antibiograma (fundamentalmente para valorar la resistencia a macrólidos, ya que no hay S. pyogenes resistentes a penicilina) y el que puede permitir distinguir entre distintos Streptococcus ß-hemoliticuss (grupos C y G además del A) u otras bacterias. Con todo, todavía no hay un método estandarizado de forma internacional para la investigación mediante cultivo de S. pyogenes, y no son siempre los mismos medios de cultivo o de toma de muestras los utilizados por los distintos laboratorios.
Desde la década de los 80, se han ido desarrollando test de detección rápida de antígeno estreptocócico basados en la detección del antígeno carbohidrato específico de la pared celular de los Streptococcus ß-hemoliticuss exclusivamente del grupo A. Los primeros utilizaron técnicas de coaglutinación y aglutinación con partículas de látex y ofrecieron una buena especificidad (90-99%), pero una insuficiente sensibilidad (75-90%). Posteriormente, se desarrollan otros basados en técnicas de enzimoinmunoanálisis, e incluso los más recientes basados en inmunoanálisis óptico presentan una precisión diagnóstica muy próxima a la del cultivo (84 a 99% de sensibilidad y 95 a 99% de especificidad), además de disponer del resultado en plazos ahora muy cortos (5-10 minutos)20.
Parece entonces lógico que si desde las consultas de Atención Primaria debemos de precisar el diagnóstico de la faringoamigdalitis para seleccionar las candidatas a tratamiento antibiótico y dado que los actuales TRDA aportan una buena precisión diagnóstica en un tiempo más que razonable, sin demorar el tratamiento en un plazo en que podemos perder la ventaja de la mejoría clínica del paciente (como sucede si esperamos al resultado del cultivo), dispongamos en las consultas de estos test como dotación habitual para realizarlos a aquellos pacientes que presenten un mínimo de criterios clínicos (Centor 3-4).
Apoyando esta propuesta, diferentes estudios de evaluación económica han valorado las diferentes opciones diagnósticas y terapéuticas en el tratamiento de la FAS. Un estudio de 2002 de coste-efectividad21 recomienda en sus
conclusiones que para reducir la incidencia de FR de forma coste-efectiva el manejo de la faringitis pediátrica debe incluir el TRDA, ya que la sensibilidad de estos nuevos test continúa mejorando y cada vez se aproxima más a la del cultivo. Y otro y más reciente estudio22 concluía que la opción de no tratamiento en faringitis en niños era la de más baja morbilidad, pero sus costes comparativamente mayores estaban fundamentalmente en las pérdidas de horas de trabajo de los padres, y que, además, antes de recomendar la opción de no tratar frente a tratar en las FAS, se necesitan estimaciones precisas del riesgo de desarrollar FR y abscesos periamigdalinos en cada población. Con todo, la pauta de mejor coste-utilidad en este estudio es la que recomienda test de detección rápido y posterior tratamiento si se confirma como estreptocócica.
De las nueve GPC valoradas, siete recomiendan realizar test diagnóstico. Cuatro de ellas recomiendan TRDA9,10,14,15, y tres prefieren realizar cultivo y esperar al resultado si el estado del paciente lo permite11-13. Tres de las cuatro guías que proponen TRDA recomiendan hacer cultivo posterior para confirmar los negativos en todos los casos, y la guía finlandesa14 propone realizar cultivo de confirmación en los TRDA negativos excepto en menores de cuatro años en los que al ser menos probable la FAS asume el riesgo de falso negativo del test rápido.
COMPLICACIONES
Si bien en la gran mayoría de ocasiones la FAS en niños sanos no tratados evolucionaría como una infección autolimitada en el tiempo, se pueden dar dos tipos de complicaciones3:
- Complicaciones supurativas: otitis media, sinusitis aguda, absceso periamigdalino, y, excepcionalmente, absceso retrofaríngeo, mastoiditis, adenitis cervical supurada, neumonía estreptocócica, infección metastásica (absceso cerebral, endocarditis, meningitis, osteomielitis o absceso hepático), síndrome de shock tóxico estreptocócico y enfermedad de Lemierre.
- Complicaciones no supurativas: fiebre reumática (FR) y glomerulonefritis postestreptocócica. Estas complicaciones son raras en países desarrollados, pero todavía un problema de salud relevante en países en vías de desarrollo, donde la frecuencia de la FR oscilaría entre un 3 y un 0,3% de las FAS (incidencias de hasta 500 casos por 100 000 habitantes, frente a 0,5 por 100 000 en países desarrollados)3. Así mismo, algunas etnias (maoríes, aborígenes australianos, indígenas de las islas del pacífico neozelandesas, castas de zonas deprimidas del Sur de la India…) tienen mayor predisposición a padecer FR, por lo que en estos casos se recomienda ser mucho más intervencionistas en el diagnóstico y en el tratamiento.
RECOMENDACIONES SOBRE EL TRATAMIENTO DE LA FAS
El debate se plantea sobre la necesidad o no de tratar una infección que en la gran mayoría de casos en las sociedades desarrolladas sería autolimitada y sin secuelas, pero que puede plantear las complicaciones supurativas y no supurativas ya comentadas. El tratamiento antibiótico parece reducir algo la duración de la enfermedad, y en mayor medida el periodo de contagiosidad, lo que permitiría el retorno al colegio de forma anticipada. Por el contrario, no está muy claro si el tratamiento inicial antibiótico ofrece un beneficio clínicamente muy superior al tratamiento sintomático y no hay evidencia de que aquel disminuya la infección recurrente.
Una revisión sistemática Cochrane23 investigó los beneficios del tratamiento antibiótico en la faringoamigdalitis. Incluyó ensayos clínicos que estudiasen la utilización de antibióticos frente a grupo control. Finalmente, obtuvo datos de 27 estudios (12 835 casos de todas las edades). El dolor de garganta y la fiebre se redujeron utilizando antibióticos. La principal diferencia se apreció al tercer día (riesgo relativo [RR]: 0,58; IC 95%: 0,48 a 0,71 en los casos con cultivo positivo. Número necesario a tratar para obtener beneficio [NNTB]: 3,7; IC 95%: 3,2 a 4,4). Sin embargo, el NNTB con antibiótico para prevenir un caso de odinofagia al séptimo día fue de 21. Se estima una reducción de la sintomatología (fiebre, odinofagia y cefalea) atribuible al antibiótico de 16 horas en los primeros días.
Respecto a la FR, en esta misma revisión, los antibióticos reducirían su incidencia en casi tres de cada cuatro casos (RR: 0,29; IC 95%: 0,18 a 0,44). No obstante, hay que tener en cuenta que la mayoría de ensayos que valoran esto son de los años 1950-60, cuando la incidencia de FR en esas poblaciones era mayor a la actual (considerando los estudios anteriores a 1975, último año en que los estudios que valora la revisión recogen casos de FR, NNTB: 77; IC 95%: 54 a 138). También quedó claro que el tratamiento antibiótico es eficaz para prevenir esta complicación aun cuando se retrase su instauración hasta nueve días24. Como ya es sabido, la glomerulonefritis postestreptocócica no es evitable con el tratamiento antibiótico de la amigdalitis, y los datos de la revisión lo confirman con un RR de dicha complicación en los tratados frente a los no tratados de 0,22 (IC 95%: 0,02 a 2,08).
Y en cuanto a las complicaciones supurativas los antibióticos consiguieron una importante reducción en la complicación OMA (NNTB: 44, IC 95%: 27 a 112), y en la aparición de absceso periamigdalino (calculado con los seis estudios posteriores a 1987, NNTB: 42; IC 95%: 28 a 82), sin obtenerse mejoría en la complicación sinusitis (RR: 0,48; IC 95%: 0,08 a 2,76).
Por último, y respecto a los efectos del tratamiento antibiótico, parece establecido que la contagiosidad de la infección desaparece a las 24 horas de inicio del tratamiento antimicrobiano en prácticamente todos los casos, situación que no puede asegurarse en los no tratados hasta un periodo mínimo de siete días tras el inicio del cuadro clínico25.
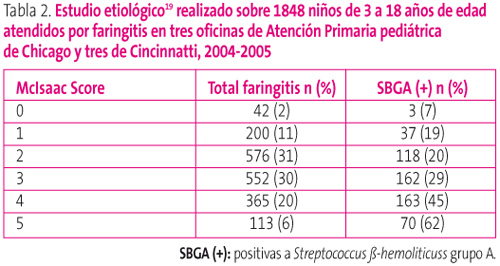
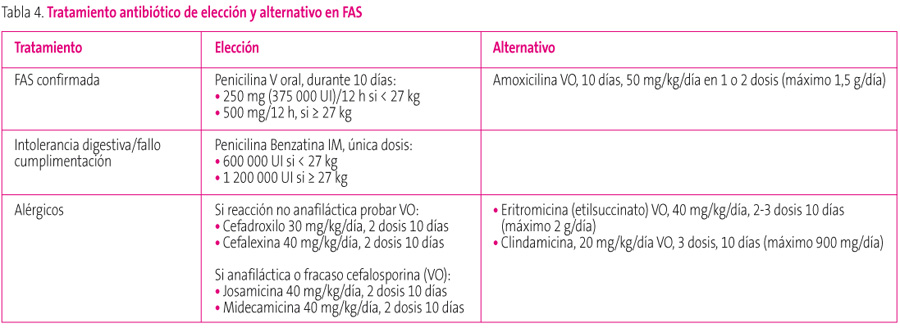
Si se opta por el tratamiento de la FAS, las GPC muestran unanimidad en que ha de hacerse con penicilina (y por su comodidad posológica por vía oral), ya que no se han descrito nunca resistencias a este fármaco por parte de S. pyogenes, y porque su espectro reducido generará menos resistencias en otros patógenos (tabla 3). Además, en todos los casos se adjudica el máximo nivel de evidencia a esta recomendación.
Tabla 3. Mostrar/ocultar
La duración del tratamiento parece que sigue establecida en diez días para evitar la FR y conseguir la mejor resolución clínica y bacteriológica. Los estudios iniciales que recomendaron esta pauta de diez días lo hicieron valorando sobre todo la complicación FR, pero ha habido una revisión sistemática y algún metaanálisis recientes que evalúan la recomendación. La revisión sistemática es de la Colaboración Cochrane26 y finalmente valora 20 estudios con 13 102 casos de FAS y concluye que los antibióticos orales administrados durante 3-6 días tuvieron la misma eficacia que la penicilina oral administrada por una duración estándar de diez días en el tratamiento de niños con FAS (aunque el riesgo de recurrencia bacteriológica tardía fue mayor en el tratamiento de corta duración: odds ratio [OR]: 1,31; IC 95%: 1,16 a 1,48), y afirma que en los países con tasas bajas de FR parece seguro tratar a los niños con FAS con pautas de corta duración. Un metaanálisis sobre 22 estudios encuentra tasas superiores de erradicación bacteriana con cefalosporinas en pautas de 4-5 días frente a penicilina oral diez días27, aunque cuando se utiliza penicilina cinco días frente a diez hay más fracasos en la erradicación (OR: 0,29; IC 95%: 0,13 a 0,63) en la opción corta. En la misma línea, un reciente metaanálisis28 encuentra más fracaso en la erradicación de la bacteria tras cinco días de tratamiento con penicilina V frente a diez días (tres ensayos clínicos aleatorizados [ECA], 500 pacientes, OR: 0,36; IC 95%: 0,13 a 0,99). Los efectos adversos no difirieron. Por todo ello, y como la recomendación es seguir utilizando penicilina V para el tratamiento, este deberá realizarse durante diez días.
Una de las guías (NICE) propone, como una alternativa al tratamiento antibiótico empírico inmediato, el tratamiento diferido, es decir, facilitar al paciente el antimicrobiano y explicarle los criterios que harían necesaria su administración (según la evolución clínica en las siguientes horas o días).
Cinco guías9,10,12,13,15 consideran una alternativa aceptable la amoxicilina, por su mejor palatabilidad y porque consideran que hay evidencia suficiente para ser administrada en dos e incluso en una dosis al día.
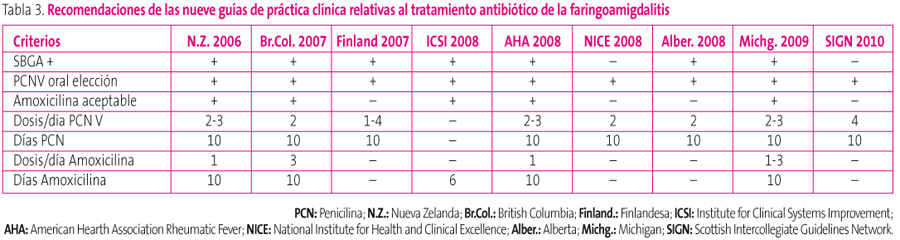
La tabla 4 resume los fármacos considerados de elección y los alternativos, así como las dosis propuestas. Conviene precisar que en nuestro país, con resistencias de S. pyogenes a macrólidos altas2, en alérgicos a penicilina deberían utilizarse macrólidos de 16 átomos de carbono (josamicina, midecamicina) con menos porcentaje de resistencias que los de 14 y 15 átomos (eritromicina, claritromicina o azitromicina). También, en niños con sospecha de alergia a penicilina y que han tenido reacciones no anafilácticas, debería probarse la utilización de una cefalosporina de primera generación para el tratamiento de estos procesos, y se escogerá como alternativa si finalmente no se producen efectos adversos.
Tabla 4. Mostrar/ocultar
Las guías de práctica clínica en general consideran que hay evidencia suficiente para administrar la penicilina V oral en dos tomas diarias en las FAS. Cuando no sea posible la vía oral, penicilina benzatina en dosis única IM, será la alternativa de elección.
TRATAMIENTO DE LA AMIGDALITIS RECIDIVANTE
En primer lugar, si el cultivo o TRDA realizado antes de cada episodio no muestra S. pyogenes, habrá que pensar que son procesos virales, por repetidos que sean, o procesos de etiología desconocida como el síndrome de Marshal (PFAPA). En los pocos casos en los que se sigue aislando S. pyogenes en los sucesivos episodios, pude pensarse en un incumplimiento del tratamiento (se recomienda ante la sospecha probar tratamiento con penicilina benzatina IM) o por un problema de ineficacia real del antibiótico (por factores asociados al huésped más que al germen, aunque también se ha elucubrado con que los anaerobios de la flora bucal podrían producir betalactamasas que disminuyesen la efectividad de los betalactámicos sobre S. pyogenes). Solamente en estos casos se recomendaría probar otros regímenes antibióticos diferentes a penicilina o amoxicilina, tales como cefalosporinas de primera o segunda generación, la asociación de amoxicilina/ácido clavulánico o la clindamicina por vía oral, aunque la evidencia sobre estas recomendaciones es escasa (series de casos)29.
En cuanto a la amigdalectomía para situaciones de amigdalitis estreptocócicas de repetición, la guía SIGN8 establece unas indicaciones muy concretas, aunque con escaso nivel de evidencia:
- Siete o más episodios de faringoamigdalitis en el último año, bien documentados, con repercusión clínica y adecuadamente tratados.
- Cinco o más de tales episodios en cada uno de los dos años precedentes.
- Tres o más de tales episodios en cada uno de los tres años precedentes.
BIBLIOGRAFÍA
- Romero Vivas J, Sánchez A, Corral O, Rubio M, Picazo JJ. Estudio de las infecciones pediátricas en el medio extrahospitalario. Rev Esp Pediatr. 1994;(Supl 63):112-6.
- Ochoa Sangrador C, Vilela Fernández M, Cueto Baelo M, Eiros Bouza JM, Inglada Galiana L; Grupo Español de Estudios de los Tratamientos Antibióticos. Adecuación del tratamiento de la faringoamigdalitis aguda a la evidencia científica. An Pediatr (Barc). 2003;59:31-40.
- Bisno AL, Stevens DL. Streptococcus pyogenes. En: Mandelli, GL, Bennett JE, Dolin R (eds.). Mandell, Douglas, and Bennett’s principles and practice of infectious diseases. Volume 2, 6th ed. Philadelphia: Elsevier Churchill Livingstone; 2005. Capítulo 195.
- Shaikh N, Leonard E, Martin JM. Prevalence of streptococcal pharyngitis and streptococcal carriage in children: a meta-analysis. Pediatrics. 2010;126:e557-64.
- Umarán A, Cisterna R, Zubiaur J, Astigarraga J, Goiria J, Arrechederra M et al. Efecto in vitro de penicilina G, ampicilina y amoxicilina/ácido clavulánico sobre estreptococos beta-hemolíticos procedentes de población escolar. Rev Esp Microbiol Clin. 1988;3:629-35.
- Danchin MH, Rogers S, Kelpie L, Selvaraj G, Curtis N, Carlin JB et al. Burden of acute sore throat and group A streptococcal pharyngitis in school-aged children and their families in Australia. Pediatrics. 2007;120: 950-7.
- NICE Short Clinical Guidelines Technical Team (2008). Respiratory tract infections–antibiotic prescribing. Prescribing of antibiotics for self-limiting respiratory tract infections in adults and children in primary care. London: National Institute for Health and Clinical Excellence. Disponible en: http://www.nice.org.uk/nicemedia/live/12015/41323/41323.pdf
- SIGN Scottish Intercollegiate Guidelines Network. Management of sore throat and indications for tonsillectomy. A national clinical guideline. Published April 2010. Disponible en http://www.sign.ac.uk/pdf/sign117.pdf
- Institute for Clinical Systems Improvement (ICSI). Diagnosis and treatment of respiratory illness in children and adults. Bloomington (MN): Institute for Clinical Systems Improvement (ICSI); 2008 Jan. 71 p. Disponible en http://www.icsi.org/guidelines_and_more/gl_os_plot_/respiratory_illness_in_children_and_adults __guideline_/respiratory_illness_in_children_and_adults__guideline__13116.html
- Gerber MA, Baltimore RS, Eaton CB, Gewitz M, Rowley AH, Shulman ST et al. Prevention of rheumatic fever and diagnosis and treatment of acute Streptococcal pharyngitis: a scientific statement from the American Heart Association Rheumatic Fever, Endocarditis, and Kawasaki Disease Committee of the Council on Cardiovascular Disease in the Young, the Interdisciplinary Council on Functional Genomics and Translational Biology, and the Interdisciplinary Council on Quality of Care and Outcomes Research: endorsed by the American Academy of Pediatrics. Circulation. 2009;119:1541-51.
- Clinical Practice Guideline working group. Alberta Medical Association. Guideline for The Diagnosis and Management of Acute Pharyngitis. Disponible en http://www.topalbertadoctors.org/informed_practice/clinical_practice_guidelines/complete%20set/Acute%20Pharyngitis/acute_pharyngitis_guideline.pdf
- Guidelines and Protocols Advisory Committee British Columbia Medical Association. Sore Throat–Diagnosis and Management. Disponible en http://www.bcguidelines.ca/gpac/pdf/throat.pdf
- New Zealand Guidelines Group. New Zealand Cardiovascular Guidelines Handbook: A summary resource for primary care practitioners. Chapter New Zealand Guideline for Rheumatic Fever (2007) 2nd ed. Wellington: New Zealand Guidelines Group; 2009. Disponible en http://www.heartfoundation.org.nz/index.asp?pageID=2145850722
- Finnish Medical Society Duodecim. Tonsillitis and pharyngitis in children. In: EBM Guidelines. Evidence-Based Medicine. Helsinki, Finland: Wiley Interscience. John Wiley and Sons; 2007.
- Michigan Quality Improvement Consortium. Acute pharyngitis in children. Southfield (MI): Michigan Quality Improvement Consortium; 2009. Disponible en http://www.med.umich.edu/1info/FHP/practicegui des/pharyngitis/pharyn.pdf
- Ebell MH, Smith MA, Barry HC, Ives K, Carey M. The rational clinical examination. Does this patient have strep throat? JAMA. 2000;284:2912-8.
- Centor RM, Witherspoon JM, Dalton HP, Brody CE, Link K. The diagnosis of strep throat in adults in the emergency room. Med Decis Making. 1981;1:239-46.
- McIsaac WJ, Kellner JD, Aufricht P, Vanjaka A, Low DE. Empirical validation of guidelines for the management of pharyngitis in children and adults. JAMA. 2004;291:1587-95. [Erratum, JAMA. 2005; 294:2700.]
- Tanz RR, Gerber MA, Kabat W, Rippe J, Seshadri R, Shulman ST. Performance of a rapid antigen-detection test and throat culture in community pediatric offices: implications for management of pharyngitis. Pediatrics. 2009;123:437-44.
- Rodríguez-Salinas Pérez E. Faringoamigdalitis aguda. En: AEPap ed. Curso de Actualización Pediatría 2004. Madrid: Exlibris Ediciones; 2004. p. 69-78.
- Ehrlich JE, Demopoulos BP, Daniel KR Jr, Ricarte MC, Glied S. Cost-effectiveness of treatment options for prevention of rheumatic heart disease from Group A streptococcal pharyngitis in a pediatric population. Prev Med. 2002;35:250-7.
- Van Howe RS, Kusnier LP 2nd. Diagnosis and management of pharyngitis in a pediatric population based on cost-effectiveness and projected health outcomes. Pediatrics. 2006;117:609-19.
- Spinks A, Glasziou PP, Del Mar CB. Antibiotics for sore throat. Cochrane Database of Systematic Reviews 2006;4:CD000023.
- Rammelkamp CH. Rheumatic heart disease: a challenge. Circulation. 1958;17:842-51.
- Snellman LW, Stang HJ, Stang JM, Johnson DR, Kaplan EL. Duration of positive throat cultures for group A streptococci after initiation of antibiotic therapy. Pediatrics. 1993;91:1166-70.
- Altamimi S, Khalil A, Khalaiwi KA, Milner R, Pusic MV, Al Othman MA. Short versus standard duration antibiotic therapy for acute streptococcal pharyngitis in children. Cochrane Database Syst Rev. 2009;21: CD004872.
- Casey JR, Pichichero ME. Metaanalysis of short course antibiotic treatment for group a streptococcal tonsillopharyngitis. Pediatr Infect Dis J. 2005;24:909-17.
- Falagas ME, Vouloumanou EK, Matthaiou DK, Kapaskelis AM, Karageorgopoulos DE. Effectiveness and safety of short-course vs long-course antibiotic therapy for group a beta hemolytic streptococcal tonsillopharyngitis: a meta-analysis of randomized trials. Mayo Clin Proc. 2008;83:880-9.
- Brook I. Beta-lactamase producing bacteria in mixed infections. Clinical Microbiology and Infectious Diseases. 2004;10:777-84.
LECTURAS RECOMENDADAS
-
Carapetis JR, McDonald M, Wilson NJ. Acute rheumatic fever. Lancet. 2005;366:155-68.
Excelente revisión sobre la tan temida complicación de la faringoamigdalitis. -
McIsaac WJ, Kellner JD, Aufricht P, Vanjaka A, Low DE. Empirical validation of guidelines for the management of pharyngitis in children and adults. JAMA. 2004;291:1587-95. [Erratum, JAMA. 2005; 294:2700.]
Sobre el diagnóstico clínico y bacteriológico de la faringoamigdalitis estreptocócica, muy buena revisión. -
SIGN Scottish Intercollegiate Guidelines Network. Management of sore throat and indications for tonsillectomy. A national clinical guideline. Published April 2010. Disponible en: http://www.sign.ac.uk/pdf/sign117.pdf
Aunque no coincide nuestro artículo con alguna de propuestas de esta guía de práctica clínica, es un excelente ejemplo de una muy buena guía promovida por el grupo escocés. -
Wessels MR. Clinical practice. Streptococcal pharyngitis. N Engl J Med. 2011;364:648-55.
Muy reciente revisión del tema. Buena actualización, aunque demasiado inclinada hacia las propuestas norteamericanas. Solo menciona, sin explicarlas, las propuestas más novedosas de las guías europeas.