Diabetes mellitus tipo 1
2 Servicio de Pediatría, Hospital Virgen de la Salud. Toledo (España).
3 Servicio de Pediatría, Hospital Virgen de la Salud. Toledo (España).
RESUMEN
La diabetes mellitus tipo 1 es una de las enfermedades crónicas más frecuentes en la edad pediátrica. La aparición de nuevas insulinas y la intensificación del tratamiento han permitido establecer nuevos objetivos de control metabólico y dar una mayor calidad de vida a niños y adolescentes. El tratamiento se sustenta en tres pilares: insulinoterapia, ejercicio y nutrición que, junto con la educación diabetológica, lograrán un control óptimo y la prevención de complicaciones a corto y largo plazo. El pediatra de Atención Primaria es fundamental en la detección precoz de la enfermedad y en el apoyo médico y psicológico al paciente y sus familiares. A su vez, debe estar preparado para afrontar situaciones comunes en el niño con diabetes, como las hipoglucemias o las enfermedades agudas intercurrentes.
INTRODUCCIÓN
La diabetes mellitus (DM) engloba un grupo de enfermedades metabólicas caracterizadas por hiperglucemia crónica debida a un defecto en la secreción y/o en la acción de la insulina. Esta hiperglucemia mantenida en el tiempo se asocia a complicaciones micro- y macrovasculares1.
En este artículo nos referiremos a la DM tipo 1a (DM 1), en la que existe un déficit total en la secreción de insulina debido a un mecanismo autoinmune contra las células beta del páncreas. En la DM 1b el factor patógeno contra las células beta es desconocido. Este subtipo de diabetes es más frecuente en otras subpoblaciones, como africanos.
La DM 1 es una de las enfermedades crónicas con mayor incidencia en la edad pediátrica. Supone el 5-10% de todos los tipos de diabetes a nivel mundial2. Sigue siendo el tipo más frecuente en la infancia, a pesar del aumento de la DM 2 paralelo al aumento del sobrepeso y la obesidad infantil3.
Como muestran los grandes estudios epidemiológicos (EURODIAB4, The SEARCH for Diabetes in Youth Study3, the Diamond Project5), la incidencia de la DM 1 es muy variable entre países o entre regiones de un mismo país, siendo en España en torno a 15-18/100 000 habitantes < 15 años de edad y año, pero se observa un aumento de incidencia durante las últimas décadas, sobre todo en niños menores de cinco años4,6.
Estamos asistiendo a un gran avance en el manejo de la DM 1 en niños y adolescentes debido, entre otros factores, al aumento de incidencia referido a nivel mundial, la evidencia de que el tratamiento intensivo puede disminuir las complicaciones crónicas microvasculares, demostrada con el Diabetes Control and Complications Trial (DCCT)7, así como la aparición de nuevas insulinas y dispositivos de administración.
Todo ello hace necesaria una puesta al día en la evidencia científica disponible para dar al paciente una educación diabetológica rigurosa, actualizada y continuada, que es la clave de un óptimo autocuidado.
ETIOPATOGENIA
Aunque existen varias teorías respecto a la patogénesis de la DM 1, y varios puntos de controversia8, la más aceptada propugna que una serie de factores ambientales desencadenarían una respuesta inmunomediada de células T contra las células beta del páncreas en individuos genéticamente predispuestos9.
De este modo, la historia natural de la enfermedad se desarrolla en cuatro fases10:
1. Diabetes preclínica
Se refiere a los meses o años que preceden a la presentación clínica. Se pueden detectar anticuerpos contra las células beta del páncreas en suero. La progresiva destrucción de las células beta da lugar a un déficit casi absoluto en la secreción de insulina.
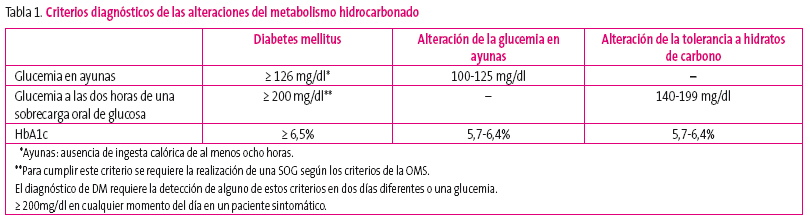
En esta fase se pueden detectar alteraciones de la glucemia sin cumplir criterios de DM, que se muestran en la tabla 12.
Tabla 1. Mostrar/ocultar
El diagnóstico diferencial de estas alteraciones de la glucemia se hará con:
- Fase incipiente de la DM 1.
- DM 2, que suele asociar sobrepeso-obesidad y datos de resistencia a insulina.
- Diabetes monogénica, que presenta gran componente familiar (herencia autosómica dominante).
- Hiperglucemia de estrés o farmacológica.
Actualmente no existe ninguna acción preventiva o que retrase la evolución de la enfermedad, por lo que en pocas ocasiones está justificado el estudio del HLA de riesgo, la determinación de autoanticuerpos o una sobrecarga oral de glucosa.
2. Presentación clínica
La presentación de la DM 1 puede variar desde una forma no urgente hasta una deshidratación severa con shock, que supone una urgencia vital. La clínica cardinal secundaria a la hiperosmolaridad plasmática consiste en la presentación progresiva de poliuria, polidipsia, polifagia y pérdida de peso. En otras ocasiones, la forma de presentación puede ser atípica, por lo que un método sencillo y sensible en Atención Primaria para excluir el diagnóstico de DM es la realización de una tira de orina. La presencia de glucosuria (siempre patológica) y cetonuria (que con glucosuria positiva traduce un déficit de insulina) obliga a la determinación de una glucemia capilar o venosa (si es ≥ 200 mg/dl confirma el diagnóstico de DM 12).
Las formas de presentación atípica de DM 1 serían:
- Enuresis en un niño con control previo de esfínteres.
- Candidiasis vaginal (chicas prepúberes).
- Fallo de medro o pérdida de peso.
- Irritabilidad, astenia, empeoramiento del rendimiento escolar, cambios de humor.
- Infecciones cutáneas recurrentes.
Las situaciones que podrían retrasar el diagnóstico de una cetoacidosis diabética (CAD) son:
- Niños muy pequeños o lactantes, por la evolución más rápida a CAD y por tener menos en cuenta el diagnóstico.
- Polipnea, se puede confundir con asma o neumonía (no hay tos, y la auscultación pulmonar es normal).
- Vómitos, pueden hacer pensar en gastroenteritis o sepsis.
- Dolor abdominal, puede ser similar al de un abdomen agudo.
- Poliuria/enuresis, puede hacernos pensar en una infección de orina (tira de orina).
- Polidipsia, puede confundirnos con una causa psicógena.
Ante un niño con el diagnóstico de DM y síntomas, siempre hay que remitirlo a un centro hospitalario para iniciar el estudio y tratamiento y evitar la evolución a CAD (dolor abdominal, vómitos, polipnea, deshidratación, etc.).
3. Fase de “luna de miel” o remisión parcial
En aproximadamente un 80% de los niños y adolescentes se produce una reducción transitoria de las necesidades de insulina al iniciar la insulinoterapia, con niveles de glucemia más estables. Esta fase se debe a la reserva pancreática de células beta en mayor o menor cuantía.
La definición actual considera aquella fase en la que el paciente necesita menos de 0,5 UI de insulina por kg de peso al día y la hemoglobina glucosilada (HbA1c) es < 7%11.
Esta fase de remisión parcial se presenta a los días o semanas del inicio de la insulinoterapia y puede durar semanas o meses (media de 10-12 meses y hasta dos años) y es más rara en niños muy pequeños o si el debut fue como CAD. Es muy importante es esta etapa informar a los padres de:
- El carácter transitorio de esta fase, que nunca evolucionará a la remisión total.
- La disminución de las necesidades de insulina e incluso la omisión en algún horario.
4. Fase crónica
Es un proceso gradual desde la fase anterior que culmina con el agotamiento funcional de las células beta y la dependencia de la terapia con insulina. Esta fase se puede ver acelerada por enfermedades intercurrentes.
Hay que tener en cuenta que la administración de insulina exógena es la única forma de tratamiento que existe para la DM 1 y que otras formas de tratamiento están en fase de investigación.
EDUCACIÓN DIABETOLÓGICA
La educación diabetológica es una parte clave en el manejo de la DM 1. El tratamiento intensivo requiere un adecuado manejo por parte del paciente y para ello es necesario un plan educativo, apoyo y motivación continuados7.
La evidencia disponible demuestra un efecto beneficioso modesto de las intervenciones educativas en niños y adolescentes en el control glucémico, sin embargo, el efecto positivo en parámetros psicosociales y de calidad de vida es claro, lo que tiene su importancia tratándose de una patología crónica12.
Existen múltiples guías publicadas, pero para que un programa de educación diabetológica tenga éxito deben tenerse en cuenta las siguientes consideraciones13:
- La intervención ha de realizarse de modo estructurado: con un programa planificado, adaptado a las necesidades, contexto y edad del paciente, de forma progresiva y continuada.
- Tendrá unos objetivos principales (conseguir un mejor control metabólico, potenciar el autocuidado y la autonomía) y específicos (promover la adquisición de hábitos saludables, conocimientos y actitudes positivas).
- La responsabilidad de impartir la educación se reparte entre Atención Especializada (en el debut, revisiones y formando a educadores en diabetes), Atención Primaria (de forma más continuada) y las asociaciones de diabéticos.
- Ha de ser accesible al paciente, a su familia y a sus cuidadores.
- Los contenidos a impartir incluyen: conocimientos (fisiología, dieta, ejercicio…), habilidades (autoinyección, autocontrol, confección de dietas) y actitudes (aceptación y adaptación a la enfermedad, autorresponsabilización, colaboración).
- Los encargados de impartir la educación diabetológica deben tener conocimientos en pedagogía y habilidades educativas para asegurarse de la correcta transmisión de conocimientos.
TRATAMIENTO
El tratamiento de la diabetes se sustenta en tres grandes pilares: la administración de insulina, la dieta y el ejercicio físico. Se les debe dar el mismo peso dentro del manejo de la DM 1, y así lo debe entender el paciente y sus familiares, no solo para obtener un control glucémico óptimo si no para prevenir las complicaciones vasculares a largo plazo.
Insulinas
En los últimos diez años hemos asistido a la aparición de nuevas insulinas mediante la modificación de la molécula. Estas presentan un perfil farmacocinético más favorable, tanto para la calidad de vida del paciente como para realizar una terapia intensiva con menos complicaciones, fundamentalmente la hipoglucemia14. El tratamiento con insulina subcutánea persigue imitar la secreción fisiológica de insulina por el páncreas mediante una insulina continua por la noche y entre comidas (basal) y otra en respuesta a las comidas (picos). Esta estrategia se conoce como basal/bolus.
Insulinas tradicionales
La insulina basal ideal sería aquella sin pico de acción, con vida media larga y absorción predecible. Para este fin se utiliza la insulina neutral protamine Hagedorn (NPH), pero no cumple estas premisas: posee un pico importante de acción a las 2-3 horas (causante de hipoglucemias), su vida media corta hace que se tengan que administrar tres dosis y su absorción es muy variable. Asimismo, la insulina ideal para utilizar en bolo sería aquella con un inicio muy rápido de acción y un pico y una vida media cortos. Para este fin se usa la insulina regular, pero tampoco se ajusta a este perfil: tiene un inicio lento de acción (30-45 minutos), un pico tardío (a los 90-12 minutos) y una vida media demasiado larga (5-6 horas).
Análogos de acción lenta
Actualmente disponemos de dos: insulina glargina y detemir. Se caracterizan por su difusión lenta al torrente sanguíneo, por lo que presentan poco pico, su vida media está entre 20 y 24 horas y presentan una absorción menos variable.
Como ventajas, estas insulinas ofrecen: facilitar la aplicación del régimen basal/bolus, disminuir la frecuencia y gravedad de hipoglucemias nocturnas y mejorar el perfil metabólico y la ganancia de peso que se observa en las pautas intensivas. Como desventajas tenemos que su uso solo está autorizado en mayores de seis años, por lo que requiere un “uso compasivo” con firma de consentimiento informado en los menores, que no pueden mezclarse en la misma jeringa con otras insulinas y que se desconoce su perfil de seguridad a largo plazo.
Análogos de acción rápida
Disponemos de tres análogos de acción rápida: insulina lispro, aspart y glulisina. Las caracteriza un inicio de acción muy rápido (10-15 minutos), lo que permite comer 5-10 minutos tras su administración, o administrarla al terminar de comer (niños pequeños con forma de comer caprichosa). Tienen una vida media corta (2-3 horas), por lo que no hay tanto riesgo de hipoglucemias postprandiales tardías.
Como ventajas, mejora la calidad de vida del paciente y facilita la aplicación del régimen basal/bolus. Como desventajas, es necesario administrar insulina en cada comida, aumenta el riesgo de hipoglucemias postprandiales precoces y se desconoce el perfil de seguridad a largo plazo.
Formas de administración de insulina subcutánea
El DCCT demostró con sólida evidencia que las terapias intensivas (múltiples dosis de insulina –MDI– subcutánea o bombas de infusión subcutánea de insulina –ISCI–) daban lugar a menor número de complicaciones a largo plazo que pautas de dos dosis al día7. No obstante, no existe evidencia sólida de la superioridad de la ISCI frente a MDI en población pediátrica.
Aunque la administración mediante ISCI es la más fisiológica, no todos los hospitales tienen la infraestructura requerida para ofrecer este tipo de terapia. Consiste en un dispositivo que administra de forma subcutánea una insulina continua y bolos preprandiales, ambos son programados por el paciente o sus familiares y existen diferentes tipos en ambas modalidades. Precisa la realización de 6-9 controles de glucemia capilar diarios y control de los hidratos de carbono de la dieta. Entre las principales indicaciones estarían: pacientes con mal control metabólico a pesar del tratamiento intensivo, hipoglucemias graves, recurrentes o desapercibidas, “fenómeno del alba” importante, complicaciones microvasculares y/o tendencia a complicaciones macrovasculares, tendencia a la cetosis, y deseo de mejorar la calidad de vida15.
Nutrición
No existen evidencias científicas sólidas respecto a pacientes pediátricos. Uno de los puntos clave en el consejo dietético será adaptarse a las necesidades de cada paciente y animar a adoptar hábitos saludables más que imponerlos. Llevar un horario regular de comidas y adquirir hábitos como comer sentado con la familia, educar sobre dietas saludables y monitorizar la ingesta se asocian a un mejor control glucémico16.
Principios generales
- La dieta debe aportar la energía y los nutrientes necesarios para asegurar un crecimiento y desarrollo adecuados y mantener un índice de masa corporal normal.
- Con el fin de tener un horario de monitorización de la glucosa, evitar excesos y crear hábitos, se organiza la dieta en tres comidas principales, una a media mañana y una merienda.
- La pauta de insulina debe adaptarse a la forma de comer de la familia, así como a los cambios en el apetito (día a día, en la pubertad).
- Los cambios en la dieta suponen un cambio en los estilos de vida e involucran a toda la familia, por lo que habrá que tener en cuenta las peculiaridades culturales y el entorno social a la hora de llevarlos a cabo.
- En general, las recomendaciones para la población general son válidas para la DM 1.
Composición de la dieta y necesidades energéticas
El aporte calórico es similar al de un niño no diabético de la misma edad. Se suele calcular en función de la edad mediante la fórmula: 1000 + (100 x edad en años) kcal/día. Esta fórmula sería válida hasta los diez años en niñas y hasta los 15 años en niños. A partir de esta edad, las mujeres suelen necesitar no más de 2000 kcal/día y los hombres entre 2500 y 3000 kcal. Este cálculo es una aproximación inicial, pero el aporte calórico debe adaptarse a la actividad física, el apetito, etc., asegurando un crecimiento y un peso adecuados.
Las calorías se reparten entre los diferentes nutrientes de la siguiente forma:
- Hidratos de carbono: 50-55%.
- Proteínas: 10-15%.
-
Grasas: 30-35%, de las cuales:
- < 10%: grasas saturadas y ácidos grasos trans.
- < 10%: grasas poliinsaturadas.
- > 10%: grasas monoinsaturadas, como el aceite de oliva (hasta el 20% del aporte energético total).
- Fibra: 15-30 g/día
Es recomendable consumir productos frescos y cereales integrales, aumentar el consumo de frutas y verduras y consumir sacarosa de forma moderada (hasta un 10% del total). No se deben prohibir alimentos, pero algunos (como helados o bebidas azucaradas) se consumirán de forma excepcional y al final de comidas que contengan proteínas o grasas, para enlentecer su absorción. Al igual que en la población pediátrica general, no se recomienda el aporte de vitaminas o minerales a menos que exista un déficit específico.
Aunque no existe un consenso sobre el método educativo a elegir, se seleccionará aquel que resulte más sencillo para el paciente, y el control metabólico permitirá saber si es el adecuado.
Ningún método ha demostrado ser superior a otro en establecer la relación entre tipo y cantidad de hidratos de carbono ingeridos y la respuesta en forma de glucosa en sangre. Los más utilizados son:
Método de raciones
Se basa en utilizar la ración como unidad de hidratos de carbono. Cada ración equivale a 10 g de hidratos de carbono. De esta forma, podemos calcular el número de raciones diarias a partir de las necesidades calóricas, repartirlas en las diferentes comidas e intercambiar alimentos, siempre que se mantenga el número total de raciones. Existen tablas que indican cuánta cantidad de un determinado alimento equivale a una ración (una ración equivale a 200 cc de leche de vaca, 75 g de manzana, 20 g de pan blanco...)17.
Índice glucémico
Informa de cómo actúa en el organismo un determinado alimento elevando la glucemia. Se calcula comparando la glucemia en sangre las dos primeras horas tras la ingesta de un alimento con la glucemia que se obtiene si se ingiere glucosa. A mayor índice glucémico, mayor y más rápida será la elevación de la glucemia. Alimentos con bajo índice glucémico son: cereales integrales, frutas y yogur17. En algún estudio en niños, esta estrategia consigue un mejor control metabólico que otras.
Cociente insulina/hidratos de carbono
Permite calcular las unidades de insulina necesarias para metabolizar una ración de hidratos de carbono y así variar la ingesta más libremente. Es válido para pacientes en régimen de MDI o ISCI. Este método ha demostrado mejorar la calidad de vida en adultos.
Ejercicio
La práctica de ejercicio físico regular ha demostrado beneficio en el control del peso y el desarrollo de complicaciones vasculares, así como en la sensación de bienestar, pero poco efecto en el control metabólico. Para que aporte el máximo beneficio, el ejercicio ha de ser aeróbico, de intensidad moderada, practicarse de forma regular y preferiblemente en grupo y al aire libre. A la hora de practicar un ejercicio programado hay que tener en cuenta algunas puntualizaciones respecto al control metabólico, la administración de insulina y la ingesta de hidratos de carbono.
Control metabólico
Para minimizar el riesgo de complicaciones (hipo- e hiperglucemia y cetoacidosis), lo ideal es realizar el ejercicio cuando existe un buen control metabólico y normoglucemia. Si existe hiperglucemia > 250 mg/dl, se realizará una determinación de cetonemia o cetonuria para comprobar la existencia de cuerpos cetónicos que contraindican la realización del mismo. Si es negativa, se podrá realizar ejercicio si se está bajo el efecto de alguna insulina previa. Se deben realizar controles de glucosa capilar antes de realizar un ejercicio no habitual, durante el ejercicio si hay síntomas de hipoglucemia o es muy prolongado, y hasta las 12-24 horas posteriores, por el riesgo de hipoglucemias tardías19.
Administración de insulina
A la hora de elegir el sitio de administración de la insulina se deben evitar las extremidades que se usarán más (como las piernas en el ciclismo), ya que el aumento de flujo sanguíneo hacia la zona aumenta la absorción de la insulina y el riesgo de hipoglucemia. Asimismo, las temperaturas altas también incrementan la absorción.
En general, suele bastar con reducir la insulina basal y los bolos de insulina ultrarrápida preprandiales en las comidas posteriores y previas al ejercicio, aunque algunas veces el aumento de ingesta de hidratos de carbono es suficiente. Habrá que individualizar según la respuesta previa de cada paciente y el tipo e intensidad del ejercicio.
Las hiperglucemias de estrés, secundarias a la liberación de hormonas contrarreguladoras, suelen ser transitorias y pueden ir seguidas de una hipoglucemia, por lo que no se suelen tratar.
En niños portadores de bombas de insulina se puede reducir de forma temporal la insulina basal durante el ejercicio, así como los bolos prandiales. En ciertos deportes, como los de contacto, una buena opción es desconectar la bomba. Se hará 90 minutos antes del ejercicio y como máximo durante dos horas. Esta opción puede dar lugar a hiperglucemias postejercicio exageradas, lo que puede evitarse administrando una pequeña dosis de insulina rápida a la mitad o inmediatamente después del ejercicio.
CONTROL GLUCÉMICO: AUTOCONTROL
Para la monitorización del control glucémico, disponemos de tres herramientas principales: la glucemia capilar diaria, la HbA1c y la determinación de cuerpos cetónicos en sangre y orina. Esta estrategia permite conocer el grado de control del paciente para establecer objetivos terapéuticos realistas y prevenir las complicaciones agudas y crónicas. En este sentido, la HbA1c elevada es la medida que se asocia con más evidencia al desarrollo de complicaciones vasculares a largo plazo7. Sin embargo, presenta una serie de limitaciones, ya que ofrece una media de la glucemia en los tres meses previos, se ve influenciada por los valores altos y bajos, y el 50% del valor corresponde a las últimas cuatro semanas. De este modo, un valor bajo de HbA1c podría corresponder a hipoglucemias de repetición, por lo que la HbA1c óptima sería aquella cercana a la normalidad y que evite tanto las hipoglucemias como periodos prolongados de hiperglucemia. Para todos los grupos de edad se establece un valor < 7,5%. La mejor forma de alcanzar este objetivo es la monitorización frecuente de glucosa (4-6 veces al día) para administrar la insulina adecuada, según la ingesta de hidratos de carbono y el ejercicio físico. Actualmente, otro concepto que cobra importancia es el de “variabilidad glucémica”: se demuestra que a un mismo valor de HbA1c en adultos, aquellos con tratamiento intensivo tienen valores medios de glucemia más bajos y menor riesgo de desarrollar retinopatía diabética20.
Aunque los objetivos de glucemia deben ser individualizados según la edad, la fase de la enfermedad, la actividad física, etc., una recomendación sería mantener glucemias preprandiales entre 80 y 140 mg/dl y postprandiales entre 100 y 180 mg/dl21. Una herramienta muy útil, aunque no siempre disponible, es la monitorización “continua” de glucosa mediante un dispositivo con sensor subcutáneo que mide la glucemia intersticial cada 1-20 minutos. Esto permite establecer objetivos de control glucémico más bajos y, por tanto, menor cifra de HbA1c.
El siguiente elemento clave en el autocontrol es la determinación de cuerpos cetónicos en sangre u orina. La determinación en sangre, cuando esté disponible, es más útil para evitar visitas a urgencias y determinar el riesgo de cetoacidosis que en orina22. Se debe a que la determinación en sangre detecta el β-hidroxibutirato, mientras que en orina detecta el acetoacetato que está en menor concentración en sangre y refleja la producción en las 4-2 horas previas. Se recomienda su realización durante enfermedades intercurrentes con fiebre y/o vómitos, en caso de hiperglucemia > 250 mg/dl mantenida a pesar de tratamiento insulínico, ante poliuria persistente con glucemia elevada y dolor abdominal, ante polipnea, etc.
Para que el autocontrol sea eficiente es fundamental que el niño o la familia lleven un registro diario de las glucemias, insulina administrada, raciones de hidratos de carbono, ejercicio realizado u otros datos de interés. Estos datos no se usarán para juzgar si no para discutir cambios en el tratamiento, tanto en la consulta como por el propio paciente.
HIPOGLUCEMIA
La hipoglucemia se produce cuando hay un disbalance entre la dosis de insulina, la ingesta de hidratos de carbono y el ejercicio realizado. Hay factores de riesgo de hipoglucemia no modificables (edad –infancia y adolescencia– y diabetes de larga duración) y modificables (cifras bajas de HbA1c y dosis altas de insulina). No existe un consenso para la definición numérica de hipoglucemia en pacientes con DM 1, pero actualmente se usa el límite de 70 mg/dl propuesto por la Asociación Americana de Diabetes (ADA)23. Valores entre 65 y 70 mg/dl se asocian a riesgo de hipoglucemia severa por alteración de la respuesta de hormonas contrarreguladoras. Los síntomas que suelen acompañar a la hipoglucemia son de dos tipos: autonómicos (temblor, palidez, sudor frío, palpitaciones) y neuroglucopénicos (visión borrosa, dificultad para concentrarse, confusión, pérdida de conciencia, convulsiones). En niños, sobre todo pequeños, es más frecuente que aparezcan alteraciones conductuales como llanto, irritabilidad, etc., y síntomas inespecíficos como hambre, cefalea, astenia o náuseas. El umbral de glucemia en el que aparecen los síntomas puede alterarse si en las horas previas han existido hipo- o hiperglucemias o durante el sueño24. De este modo, las 24 horas siguientes a una hipoglucemia los síntomas se presentan con menor intensidad y hay más riesgo de hipoglucemias desapercibidas. Asimismo, pueden notarse síntomas cuando la glucemia esté bajando, aun estando en rangos normales. Todo esto, junto al grado de desarrollo, puede dificultar el reconocimiento de las hipoglucemias en los niños.
La clasificación clásica de la hipoglucemia se basa en la capacidad del paciente para corregirla, esto no tiene mucha relevancia clínica en caso de hipoglucemia leve/moderada en niños que necesitan la ayuda de los cuidadores. Sin embargo, la hipoglucemia severa es aquella en la que hay una alteración del estado mental y la corrección de la glucemia solo puede llevarse a cabo por vía intravenosa. Esta situación es una urgencia médica y se tratará con inyección intramuscular o subcutánea de glucagón (10-30 μg/kg o 0,5 μg en < 12 años y 1 μg en > 12 años) fuera del ambiente hospitalario y/o con perfusión continua de glucosa si está disponible. Una vez se recupere la conciencia, se trata como el resto de hipoglucemias. En el caso de hipoglucemia leve/moderada habrá que mantener al paciente en reposo, ofrecer media o una ración de hidratos de carbono de absorción rápida (zumo) según el peso, comprobar a los 10-15 minutos que las cifras de glucosa están en valores normales y ofrecer media o una ración de hidratos de carbono de absorción lenta o adelantar la siguiente comida para mantener la glucemia normal.
La prevención de las hipoglucemias es una herramienta importante en el manejo de la DM 1. Existe una asociación dependiente de la edad entre hipoglucemias y deterioro cognitivo, siendo evidente en menores de seis años25 y recientemente se han propuesto las hipoglucemias de repetición como potencial factor de riesgo de aterosclerosis precoz26. Algunas recomendaciones para la prevención de la hipoglucemia incluyen27:
- Mantener la glucemia por encima de 70 mg/dl con un buen control glucémico.
- Educar a paciente, familiares y cuidadores en los factores de riesgo y situaciones asociadas a hipoglucemia, así como en su reconocimiento y manejo.
- Tener siempre a mano un sistema de medición de glucosa y alimentos con hidratos de carbono de absorción rápida y fácil deglución.
- A ser posible, los niños y adolescentes con DM 1 deben llevar algún tipo de identificación de la misma.
- El glucagón debe estar disponible para familiares y cuidadores, quienes deben saber usarlo.
ENFERMEDADES AGUDAS INTERCURRENTES
Los pacientes diabéticos con buen control metabólico no presentan más riesgo de enfermedades infecciosas que los niños sin diabetes de la misma edad. En un estudio en adultos con DM 1 y buen control metabólico, se objetiva mayor incidencia de infecciones del tracto urinario, infecciones bacterianas cutáneas y de mucosas28. Sin embargo, los pacientes pediátricos con mal control metabólico pueden presentar alteraciones de la inmunidad y mayor predisposición a padecer infecciones29. Durante las enfermedades agudas, en los pacientes con DM 1 hay que tener en cuenta una serie de principios generales30:
- Las necesidades de insulina pueden aumentar unos días antes del inicio de la enfermedad, durante el periodo de incubación, y persistir elevadas unos días después de la resolución del cuadro por la resistencia a insulina.
- Nunca hay que interrumpir la administración de insulina, ya que aumentaría el riesgo de cetoacidosis.
- Hay que aumentar el número de controles de glucemia capilar al día (hasta cada 1-2 horas) y cuerpos cetónicos en sangre u orina para un mejor manejo.
- Los vómitos en un paciente con DM 1 deben considerarse secundarios a un déficit de insulina hasta que se demuestre lo contrario.
- El paciente debe recibir el tratamiento adecuado para la enfermedad que presente. La presencia de hidratos de carbono entre los excipientes del fármaco no contraindica su uso, basta con calcular los gramos de hidratos de carbono mirando la composición y descontarlo de las raciones. No obstante, la cantidad de hidratos de carbono suele ser despreciable. Algunos de los fármacos más frecuentemente utilizados en Pediatría carecen de hidratos de carbono entre sus excipientes.
Enfermedades que tienden a producir hiperglucemia
La mayoría de procesos infecciosos agudos, sobre todo febriles, producen una respuesta al estrés con liberación de hormonas contrarreguladoras. Esto produce aumento de la neoglucogénesis y tendencia a la hiperglucemia.
- En estas situaciones es de especial interés determinar los cuerpos cetónicos en sangre.
- Habrá que administrar dosis adicionales de insulina rápida correctora cada 2-4 horas en función de los controles de glucemia.
- Si la cetonemia es negativa o débilmente positiva, se administrará una dosis aproximada del 5-10% de la dosis total diaria de insulina (para una dosis total de 0,1 UI/kg/día, 0,05-0,1 UI/kg) y se repetirá cada 2-4 horas en función de la respuesta.
- Si la cetonemia es positiva de forma moderada-alta, se administrará una dosis aproximada del 10-20% de la dosis total diaria (0,1-0,2 UI/kg) y se repetirá cada 2-4 horas en función de la respuesta.
- Cuando hay hiperglucemia y cetonemia el aporte de hidratos de carbono cuando la glucemia baje de 250 mg/dl ayuda a negativizar la cetonemia.
- A veces es necesario aumentar la insulina basal.
- Aumentar el aporte de líquidos por las pérdidas aumentadas (sudor, orina) en forma de soluciones de rehidratación oral teniendo en cuenta el contenido en hidratos de carbono.
Enfermedades que tienden a producir hipoglucemia
Durante las infecciones digestivas, como la gastroenteritis aguda, pueden existir vómitos y diarrea, la absorción intestinal está disminuida y el vaciamiento gástrico enlentecido. Unido a la anorexia propia de la enfermedad, puede dar lugar a hipoglucemia y cuerpos cetónicos positivos por ayuno.
- En estos casos puede ser necesario disminuir la dosis total diaria de insulina un 20-50%, pero nunca suspender la administración.
- Hay que tener cuidado con las insulinas antes de la ingesta; si el niño está muy inapetente se puede esperar y administrar la insulina ultrarrápida después, en función de lo que coma.
- Se deben administrar comidas fáciles de digerir, sin grasas, con hidratos de carbono y en pequeñas cantidades frecuentes. Si el niño no tiene apetito, para mantener el estado de hidratación se pueden administrar soluciones de rehidratación oral y bebidas azucaradas.
- La monitorización de cuerpos cetónicos es útil para saber si la cantidad de hidratos de carbono administrados es suficiente (cetonemia negativa).
- Para tener una idea del estado de hidratación es útil controlar el peso, el volumen de orina y el volumen de ingesta.
Recomendaciones de cuándo consultar o remitir a un servicio de urgencias
- Existen signos claros de deshidratación, o el niño está confuso con dolor abdominal, hiperventilación...
- Vómitos incoercibles pasadas dos horas.
- Imposibilidad de mantener la glucemia por encima de 70 mg/dl.
- Cetonemia/cetonuria elevada a pesar del tratamiento corrector con insulina.
- Tendencia a elevación de la glucemia a pesar del tratamiento corrector con insulina.
- Niño pequeño, menor de 2-3 años.
- Los padres están agotados o hay problemas de comunicación por dificultades con el lenguaje.
ASPECTOS DE INTERÉS EN ATENCIÓN PRIMARIA
Vacunación
Las vacunaciones serán las mismas que en la población infantil, pero en aquellas comunidades donde no estén incluidas la vacuna antineumocócica y antivaricela hay que tener en cuenta que la Asociación Americana de Pediatría recomienda su administración a pacientes con DM 1. Del mismo modo, se recomienda la vacunación anual contra la gripe estacional en mayores de seis meses de edad. El objetivo de la vacunación en el niño con DM1 será evitar la enfermedad y el riesgo de descompensación metabólica que supone.
Salud bucodental
Hay que insistir en la importancia de la higiene bucodental y las revisiones odontológicas, ya que el riesgo de caries dental está aumentado por la toma frecuente de tentempiés ricos en hidratos de carbono. En niños con mal control metabólico existe mayor riesgo de enfermedad periodontal.

BIBLIOGRAFÍA
- Craig ME, Hattersley A, Donaghue KC. ISPAD Clinical Practice Consensus Guidelines 2009 Compendium. Definition, epidemiology and classification of diabetes in children and adolescents. Pediatric Diabetes 2009;10(Suppl 12):3-12.
- American Diabetes Association. Diagnosis and classification of diabetes mellitus. Diabetes Care. 2011;34(Suppl 1):S62-9.
- Liese AD, D´Agostino RB, Hamman RF, Kilgo PD, Lawrence JM, Liu LL et al. The burden of diabetes mellitus among US youth: prevalence estimates from the SEARCH for Diabetes in Youth Study. Pediatrics. 2006;118:1510-8.
- EURODIAB ACE Study Group. Variations and trends in incidence of childhood diabetes in Europe. Lancet. 2000;355:873-6.
- DIAMOND Project Group. Incidence and trends of childhood type 1 diabetes worldwide 1990-1999. Diabet Med. 2006;23:857-66.
- Maahs DM, West NA, Lawrence JM, Mayer-Davis JE. Epidemiology of Type 1 Diabetes. Endocrinol Met Clin N Am. 2010;39:481-97.
- The Diabetes Control and Complications Trial (DCCT)/Epidemiology of Diabetes Interventions and Complications (EDIC). Research Group. Beneficial effects on intensive therapy of diabetes during adolescence: Outcomes after the conclusion of The Diabetes Control and Complications Trial (DCCT). J Pediatr. 2001;139:804-12.
- Bonifacio E, Ziegler AG. Advances in the prediction and natural history of type 1 diabetes. Endocrinol Metab Clin N Am. 2010;39:513-25.
- Eisenbarth GS. Type I Diabetes Mellitus: A chronic autoimmune disease. N Engl J Med. 1986;314:1360-8.
- Couper J, Donaghue KC. Phases of Diabetes in children and adolescents. Pediatric Diabetes. 2009;10(Suppl 12):13-6.
- Lombardo F, Valenzise M, Vasniewska M. Two-year prospective evaluation of the factors affecting honeymoon frequency and duration in children with insulin dependent diabetes mellitus: the key role of age at diagnosis. Diabetes Nutr Metab. 2002;15:246-51.
- Switf PGF. Diabetes education in children and adolescents. Pediatric Diabetes. 2009;10(Suppl 12):51-7.
- Chena JA. Diabetes Mellitus. Aspectos para Atención Primaria de salud. Madrid: Editores Nilo; 2010.
- Tapia Ceballos L. Nuevas insulinas. Actualización. An Pediatr. 2009;70(1):65-71.
- Barrios R, García B, Gómez A, González I. Documento de consenso sobre tratamiento con infusión continua de insulina de la diabetes tipo 1 en la edad pediátrica. An Pediatr. 2010;72(5):352.e1-352.e4.
- Smart C, Aslander van-Vliet E, Waldron S. Nutritional management in children and adolescents with diabetes. Pediatric Diabetes. 2009;10(Suppl 12):100-17.
- A comer. Guía de alimentación para el niño, el joven… con diabetes tipo1. Barcelona: Bayer; 2008.
- Robertson K, Adolfsson P, Scheiner G, Hanas R, Ridell MC. Exercise in children and adolescents with diabetes. Pediatric Diabetes. 2009;10(Suppl 12):154-68.
- Comisión de diabetes de la sociedad de endocrinología pediátrica de la AEP. Lo que debes saber sobre la diabetes infantil. Madrid: Ministerio de Sanidad y Consumo. Secretaría General Técnica; 2000.
- White NH, Cleary PA, Dahms W. Beneficial effects of intensive therapy during adolescence: outcomes after conclusion of the Diabetes Control and Complications Trial (DCCT). J Pediatr. 2001;139:804-12.
- National Institute for Clinical Excellence UK (NICE). Type 1 diabetes: diagnosis and management of type 1 diabetes in children, adolescents and adults 2004. Disponible en: http://www.nice.org.uk/nicemedia/pdf/CG015NICEguideline.pdf
- Rewers A, Chase HP, Mackenzie T. Predictors of acute complications in children with type 1 diabetes. JAMA. 2002;287:2511-8.
- Workgroup on hypoglycemia ADA. Defining and reporting hypoglycemia in diabetes: a report of the American Diabetes Association Workgroup on Hypoglycemia. Diabetes Care. 2005;28:1245-9.
- Heller SR, Cryer PE. Reduced neuroendocrine and symptomatic responses to subsequent hypoglycemia after 1 episode of hypoglycemia in nondiabetic humans. Diabetes. 1991;40:223-6.
- Rovet JF, Ehrilch RM, Czuchta D. Intellectual characteristics of diabetic children at diagnosis and one year later. J Pediatr Psychol. 1990;15:775-88.
- Giménez M, Gilabert R, Monteagudo J. Repeated episodes of hypoglycemia as a potential aggravating factor for preclinical aterosclerosis in subjects with T1D. Diabetes Care. 2010;7 (epub ahead of print).
- Clarke W, Jones T, Rewers A. Assesment and management of hypoglycemia in children and adolescents with diabetes. Pediatric Diabetes. 2009;10(Suppl 12):134-45.
- Muller LM, Gorter KJ, Hak E. Increased risk of infection in patients with diabetes meelitus type 1 or 2. Nederlands Tijdschrift Voor Geneeskunde. 2006;150:549-53.
- Liberatore RR, Barbosa SF, Alkimin MG. Is immunity in diabetic patients influencing the susceptibility to infections? Immunoglobulins, complement and phagocytic function in children and adolescents with type 1 diabetes. Pediatr Diabetes. 2005;6:206-12.
- Brink S, Laffel L, Likitmaskul S. Sick day management in children and adolescents with diabetes. Pediatr Diabetes. 2009;10(Suppl 12):146-53.
LECTURAS RECOMENDADAS
- Carcavilla A. Atención al paciente con diabetes: mucho más que insulinas. Rev Pediatr Aten Primaria. 2009;11(Suppl 16):s217-38.
- Artículo interesante dirigido al pediatra de Atención Primaria que hace una revisión exhaustiva de los aspectos más relevantes de la DM 1.
- Comisión de diabetes de la sociedad de Endocrinología pediátrica de la AEP. Lo que debes saber sobre la diabetes infantil. Madrid: Ministerio de Sanidad y Consumo. Secretaría General Técnica; 2000.
- Herramienta muy útil para la educación diabetológica en el niño y adolescente. Redactada en un lenguaje sencillo y cercano la hace comprensible tanto para los familiares como para el paciente.
- ISPAD Clinical Practice Consensus Guidelines Compendium 2009. Pediatr Diabetes. 2009;10(Suppl 12).
- Revisión actualizada e imprescindible de la Academia Americana de Diabetes sobre los aspectos más relevantes de la diabetes infantil.
- Tapia Ceballos L. Nuevas insulinas. Actualización. An Pediatr. 2009;70(1):65-71.
- Artículo de actualización en terapia insulínica que ofrece una detallada información sobre aspectos farmacocinéticos, indicaciones, ventajas y desventajas de las nuevas insulinas.