Guías de práctica clínica (1.ª parte)
2 CS Delicias Sur. Zaragoza (España).
RESUMEN
Existen diferentes documentos llamados de diferentes formas: guías clínicas, guías de práctica, guías de práctica clínica, etc.; bajo nuestro punto de vista, existe cierta confusión y desconocimiento sobre cuáles de estas deben tenerse en cuentaa la hora de usar el conocimiento contenido en ellas. No todos los documentos así llamados tienen la suficiente calidad metodológica para que puedan considerarse fuentes de información basadas en las mejores evidencias o en las mejores pruebas científicas y ocupar un puesto en la cúspide de la pirámide de jerarquía de las fuentes de información1.
En este artículo intentaremos que quienes lo lean comprendan por qué, para qué y cómo debe elaborarse una Guía de Práctica Clínica de calidad, con el fin último de que se animen a su uso, es decir, a su implementación.
PUNTOS CLAVE
- No todos los documentos autodefinidos como guías de práctica clínica (GPC) lo son; existen grandes diferencias metodológicas.
- En la elaboración de una GPC es necesario seguir una metodología homogénea, contrastada y transparente; en nuestro medio, el Manual Metodológico de Elaboración de Guías de Práctica Clínica en el Sistema Nacional de Salud (SNS), es el más apropiado para lograrlo.
- El grupo elaborador debe ser multidisciplinar y los pacientes deben formar parte de él.
- Existe un programa de GPC en nuestro Sistema Nacional de Salud.
- La calidad de las GPC debe ser evaluada y es un factor determinante para confiar en su uso.
- Existen instituciones a nivel internacional y nacional que garantizan una adecuada calidad en la elaboración.
- La implementación de las GPC de calidad contrastada es un reto que deben asumir los sistemas de salud de nuestras comunidades autónomas.
DEFINICIÓN: ¿QUÉ ES UNA GUÍA DE PRÁCTICA CLÍNICA?
Existen diversas y múltiples definiciones de Guía de Práctica Clínica (GPC); así, por ejemplo, una de las más conocidas es la que recoge el Manual Metodológico de Elaboración de Guías de Práctica Clínica en el SNS, inspirada a su vez en la definición del Institute of Medicine (IOM) publicada en el año 1990 y que establece que una GPC consiste en “recomendaciones desarrolladas de forma sistemática para ayudar a profesionales y pacientes a tomar decisiones sobre la atención sanitaria más apropiada, y a seleccionar las opciones diagnósticas o terapéuticas más adecuadas a la hora de abordar un problema de salud o una condición clínica específica”2.
Desde entonces, ha habido gran profusión en la elaboración y publicación de GPC, en ocasiones presentando una elevada variabilidad en cuanto a su calidad, entendiendo calidad en términos de transparencia y rigor metodológico. Es por ello que en 2011 el IOM publicó una nueva definición de GPC como “documentos informativos que incluyen recomendaciones, dirigidas a optimizar el cuidado del paciente. Están basados en una revisión sistemática de la evidencia y en una evaluación de los beneficios y daños de las distintas opciones alternativas de cuidado”3.
Esta nueva definición introduce el término “revisión sistemática” dentro de la misma. El objeto de este cambio, según los autores, ha sido diferenciar lo que son GPC de lo que hasta ahora venían denominándose GPC pero sin serlo, como por ejemplo guías clínicas basadas en declaraciones de consenso o consejo de expertos, boletines de buenas prácticas clínicas, indicadores de calidad y recomendaciones basadas en la evidencia3.
Siguiendo esta línea argumental, el IOM determina que las GPC para ser dignas de confianza deberían3:
- Estar basadas en una revisión sistemática de la evidencia existente.
- Estar desarrolladas por un panel multidisciplinar de expertos y representantes de todos los grupos clave implicados.
- Considerar las preferencias de los pacientes y tener en cuenta importantes subgrupos de pacientes.
- Estar basada en un proceso explícito y transparente que minimice desviaciones, sesgos y conflictos de intereses.
- Proporcionar una explicación clara de las relaciones entre las distintas opciones alternativas de cuidado y los resultados en salud.
- Proporcionar un sistema de clasificación tanto de la calidad de la evidencia como de la fuerza de las recomendaciones.
- Ser revisadas cuando nueva evidencia justifique modificaciones de las recomendaciones.
JUSTIFICACIÓN: ¿POR QUÉ SE HACEN?
Son dos, principalmente, los motivos que justifican la elaboración de GPC: por un lado, la presencia de variabilidad no justificada de la práctica clínica, sobre todo cuando no hay evidencias contrastadas acerca de un manejo correcto, y por otro que el problema de salud que aborde la guía sea de gran impacto. En nuestro país, el grupo del atlas de variaciones de la práctica médica (AVPM)4 investiga estos aspectos, ofreciendo una información muy valiosa para la priorización de los temas a abordar en las guías.
El Plan de Calidad para el SNS en el año 2006 plantea dentro de su estrategia número diez de “Mejora de la práctica clínica” documentar y proponer iniciativas tendentes a disminuir la variabilidad no justificada de la práctica clínica, impulsar la elaboración y el uso de GPC vinculadas a las estrategias de salud, consolidando y extendiendo el proyecto GuíaSalud y formando a profesionales. Y por último, mejorar el conocimiento sobre la calidad de vida de los pacientes5.
Para permitir el desarrollo de las GPC se establece un convenio de colaboración entre la Agencia de Calidad del SNS y las distintas Agencias y Unidades de Evaluación de Tecnologías Sanitarias (UETS) de nuestro país. Las GPC elaboradas por las distintas Agencias y UETS dentro de este convenio conforman e integran el denominado “Programa de GPC del SNS”. El Programa de guías del SNS se coordina desde GuiaSalud-Biblioteca de GPC, organismo del SNS en el que participan las 17 comunidades autónomas para promover la elaboración y el uso de GPC. El objetivo de dicho programa es “promover la elaboración, adaptación y/o actualización de GPC basadas en la mejor evidencia científica disponible con una metodología homogénea y contrastada”6. Las primeras GPC desarrolladas dentro del Programa de GPC aparecieron publicadas en el año 2008.
Todas las guías de dicho programa se elaboran siguiendo una misma metodología establecida en el Manual Metodológico de Elaboración de Guías de Práctica Clínica del SNS2. Este manual se fundamenta en la metodología de elaboración propuesta por el Scottish Intercollegiate Guidelines Network (SIGN) y por el National Institute for Clinical Excellence (NICE).
El SIGN y el NICE son las dos instituciones británicas encargadas del desarrollo e implementación de GPC en el Reino Unido. El SIGN, fundado en el 1993, es un organismo integrado dentro del Sistema Nacional de Salud Escocés (Scotland National Health Service) con 127 guías publicadas7. El NICE, fundado en 1999, es un organismo totalmente independiente y autónomo que da respuesta a las necesidades del Sistema Nacional de Salud de Gales e Inglaterra; actualmente. su catálogo de GPC publicadas contiene 139 guías8.
OBJETIVOS: ¿PARA QUÉ SIRVEN?
Las GPC sirven para reducir la variabilidad de la práctica clínica, mejorar la transferencia de la investigación a la práctica, mejorar la calidad y seguridad de los cuidados sanitarios, ayudar al profesional sanitario y al paciente en la toma de decisiones, establecer las bases para medir, evaluar y mejorar la calidad y los resultados en salud, contribuir al desarrollo de herramientas de ayuda a la toma de decisiones, ayudar en la educación de los pacientes y cuidadores sobre las mejores prácticas y cuidados en salud y, finalmente, ayudar e informar a los gestores y decisores de políticas sanitarias sobre aquellas que son más coste-efectivas3.
El SIGN, en su manual de elaboración de guías, establece que las GPC están diseñadas para ayudar a los profesionales sanitarios a asimilar, evaluar e implementar la cada vez mayor cantidad de evidencia científica sobre las mejores prácticas a llevar a cabo. Las GPC no están pensadas para utilizarse como manuales de cocina ni como libros de texto, sino como herramientas de ayuda en la toma de decisiones sobre los cuidados más efectivos y apropiados en aquellas áreas donde existe variabilidad en la práctica clínica, afectando por tanto los resultados en salud de los pacientes9. El NICE comenta a su vez que las GPC de buena calidad cambian el proceso del cuidado de la salud, mejoran los resultados para el paciente y aseguran un uso eficiente de los recursos sanitarios, pueden usarse para desarrollar estándares para la evaluación de la práctica clínica de los profesionales sanitarios, educar y formar a los profesionales sanitarios, ayudar a los pacientes a tomar decisiones informadas y a mejorar la comunicación y la toma de decisión compartida entre el profesional sanitario y el paciente10.
METODOLOGÍA: ¿CÓMO SE HACEN?
Toda GPC de buena calidad ha de desarrollarse siguiendo una metodología sistemática y transparente, entendiendo por sistemática que ha de seguir un sistema de elaboración ya establecido, y por transparente, que toda la información recabada en cada uno de esos pasos se haga disponible de forma pública a los interesados, ya sean profesionales sanitarios, pacientes, familiares, gestores, interesados en las recomendaciones y en su implementación o metodólogos u otros grupos elaboradores de guías (GEG) más interesados en los hallazgos metodológicos durante el desarrollo de la GPC.
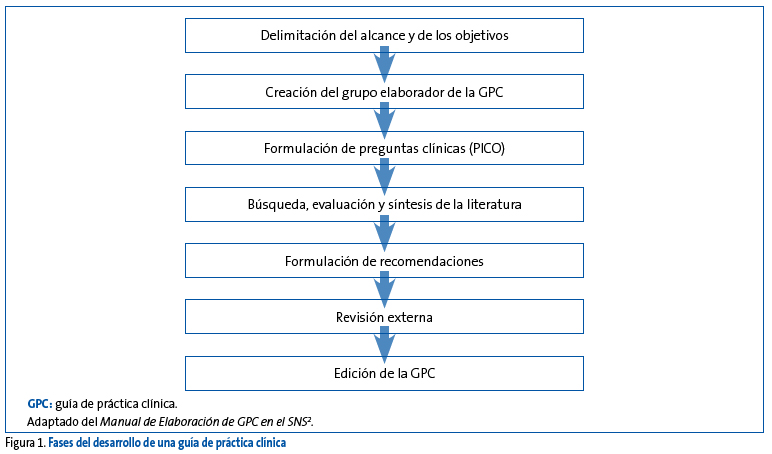
En cualquier caso, los pasos a seguir en el desarrollo de guías vienen recogidos en el Manual Metodológico de Elaboración de Guías de Práctica Clínica en el SNS (Figura 1)2.
Figura 1. Mostrar/ocultar
Definición del alcance y objetivos
Esta primera fase del desarrollo de una GPC es esencial para el buen desarrollo de todo el trabajo que se llevará a cabo más adelante. En el alcance y objetivos se debe delimitar de manera clara y específica el contenido de la guía, es decir, qué es lo que abarcará y qué es lo que no se abarcará. Adicionalmente, en esta parte se ha de recoger la justificación o la necesidad que impulsa el desarrollo de la guía, cuáles son los objetivos que se pretenden conseguir con su elaboración, a quién va dirigida o quiénes son los potenciales usuarios finales que se verán beneficiados de su uso, cuál es el ámbito de aplicación de las recomendaciones de la guía y finalmente a qué tipo de pacientes aplicarán y no aplicarán las recomendaciones de la guía.
Conformación del grupo elaborador de la guía
El GEG debe ser de carácter multidisciplinar, de forma que todos o al menos la mayoría de los perfiles de profesionales sanitarios a los que va dirigida la guía estén representados. Esto ayudará a una correcta localización y a una evaluación objetiva de la evidencia relevante a la GPC, y por supuesto facilitará la aceptación y utilización de la guía entre los usuarios finales. Otros miembros cuya participación se considera esencial son los pacientes o representantes de pacientes, ya que su presencia permite incorporar de forma directa a la guía no solo su visión, sino también sus preferencias y prioridades relacionadas con el tema de salud que aborde la GPC en cuestión.
Un aspecto trascendental que se debe tener en cuenta antes de la conformación de los grupos elaboradores es la declaración de intereses de los potenciales miembros integrantes del GEG y del manejo del conflicto de interés cuando está presente, ya sea mediante una exclusión parcial o total del proceso de elaboración de la guía. Se considera que existe conflicto de interés cuando el juicio profesional sobre un interés primario, como la seguridad de los pacientes o la validez de la investigación, está influido por un interés secundario, ya sea un beneficio financiero, de prestigio o de promoción personal o profesional2.
Formulación de las preguntas clínicas
Las preguntas que una GPC formula son del tipo denominadas foreground questions en contraposición a las background questions11.
Las background questions son preguntas o cuestiones de fondo del tipo: ¿Cuál es el proceso fisiológico, patológico? ¿Cuál es la epidemiología? ¿Cuál debe ser el tratamiento inicial?, preguntas cuyas respuestas vienen generalmente recogidas en los libros de texto y tratados de Medicina.
Las preguntas que las GPC tratan de responder son preguntas que van más allá de estos conocimientos generales o de fondo, son preguntas en el primer plano de la evidencia, o foreground questions, dirigidas a ayudar a resolver decisiones clínicas específicas. A estas foreground questions es a lo que denominamos preguntas clínicas de la guía.
Las preguntas clínicas a las que la guía trata de dar respuesta han de elaborarse teniendo en cuenta el alcance y los objetivos previamente establecidos, y han de formularse de acuerdo al formato conocido como PICO, que son las siglas de Paciente o Población, Intervención, Comparador y resultado (en inglés, Outcome). La importancia de diseccionar la pregunta en estos elementos radica en que permite definir sin ambigüedades lo que se pretende averiguar y permite construir, en base a cada uno de los componentes de la pregunta, la estrategia a la hora de realizar la búsqueda de la evidencia en las correspondientes bases de datos.
Otro aspecto importante que se debe tener en cuenta en la formulación de la pregunta es identificar qué tipo de pregunta clínica es: ¿Una pregunta sobre tratamiento, sobre una intervención diagnóstica o quizás de tipo pronóstico? Establecer el tipo de pregunta permite focalizar la búsqueda a aquellos diseños de estudios que mejor responden a cada tipo de pregunta. Así, por ejemplo, en el caso de las preguntas de tipo tratamiento, el diseño ideal de estudio para encontrar respuesta a la pregunta será el ensayo clínico aleatorizado (ECA). En el caso de estudios que evalúen la validez de una nueva prueba diagnóstica, se requieren estudios de diseño transversal donde a los pacientes se les somete a la nueva prueba diagnóstica y a continuación a la prueba de referencia o gold standard. Por último, en el caso de preguntas de tipo pronóstico, el diseño de estudio para considerar será de tipo observacional, de cohortes o de casos-controles11.
Determinar los componentes de la pregunta PICO e identificar qué diseños de estudios son los más adecuados para responder a cada una de nuestras preguntas clínicas son pasos fundamentales a la hora de interrogar correctamente a las distintas bases de datos.
Búsqueda y selección de la evidencia
Hay ciertos aspectos que deben estar claros antes de lanzar la búsqueda bibliográfica. En primer lugar, los términos de búsqueda se corresponderán con los elementos PICO de la pregunta. Estos, junto con el diseño del estudio, determinarán los criterios de inclusión y exclusión de los estudios que se van a considerar.
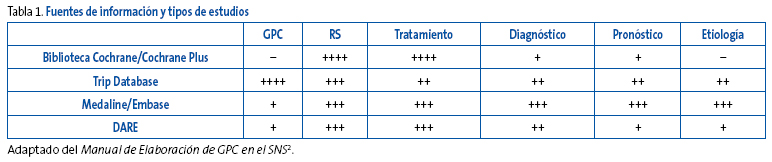
Un buen punto de partida a la hora de elaborar una GPC, es identificar si existen otras GPC de alta calidad que puedan servir como fuentes secundarias de la evidencia, de tal forma que podamos servirnos de sus estrategias de búsqueda y de su evaluación de la evidencia, y a partir de las cuales podamos actualizar nuestra búsqueda.
El siguiente paso es buscar revisiones sistemáticas (RS) del tipo de estudio que interese a nuestra pregunta en concreto. Así, por ejemplo, para una pregunta de tipo tratamiento buscaremos RS de ECA, mientras que para una pregunta de tipo diagnóstico buscaremos RS de estudios de validez diagnóstica. Por último, en los casos donde no encontremos RS que den respuesta a nuestra pregunta, habremos de buscar también estudios primarios u originales.
En la Tabla 1 se presentan algunas fuentes de información y el tipo de estudio que podemos esperar encontrar en ellas.
Tabla 1. Mostrar/ocultar
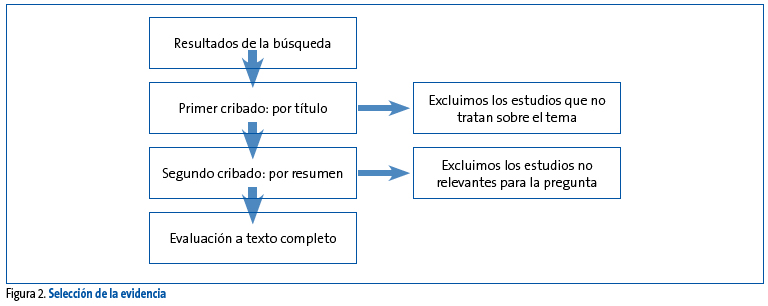
La elaboración de una GPC requiere de estrategias de búsqueda sensibles que detecten todo estudio pertinente a la pregunta PICO en cuestión y que, consecuentemente a la naturaleza de una búsqueda sensible, conduzcan a que no aparezcan entre los resultados estudios no relacionados con la temática de la GPC ni con la pregunta PICO. Por tanto, una vez que se ha realizado la búsqueda de acuerdo a los criterios de inclusión y exclusión previamente establecidos, hay que proceder a cribar los resultados de la búsqueda (Figura 2).
Figura 2. Mostrar/ocultar
El proceso de búsqueda y selección finaliza con el listado de estudios a texto completo que responden a cada una de nuestras preguntas y que a continuación deberemos evaluar críticamente.
Evaluación y síntesis de la evidencia
La búsqueda, evaluación y síntesis de la evidencia es la fase más laboriosa del proceso de elaboración de una GPC. Y aunque depende del número de preguntas que una GPC abarque, se puede considerar que esta fase del desarrollo conlleva entre 8 y 12 meses de trabajo.
Una vez que se tiene la lista de los estudios ya cribados resultado de la búsqueda, comienza la fase de lectura crítica. La lectura crítica tiene como objeto determinar la calidad o validez interna de cada uno de los estudios, es decir, la confianza en que la estimación del efecto mostrada en los distintos estudios es cierta, así como la magnitud y relevancia clínica de los resultados y la aplicabilidad de los mismos a las circunstancias de nuestro entorno sanitario.
Para llevar a cabo la evaluación de los distintos estudios, existen plantillas de lectura crítica que ayudan al evaluador a determinar la presencia de sesgos en el diseño del estudio. Estas plantillas están ajustadas a cada tipo de estudio y sirven como orientación para tener en cuenta las características intrínsecas de cada diseño. Así, por ejemplo, las plantillas de evaluación de ECA tendrán en cuenta aspectos tales como la aleatorización, el ocultamiento de la secuencia de aleatorización, el cegamiento a la intervención, la homogeneidad entre las ramas, el seguimiento, las pérdidas, el tipo de análisis (por intención de tratar o por protocolo), etc.
Sin embargo, las plantillas que se utilizan para evaluar los estudios de pruebas diagnósticas tienen en consideración si la prueba estudiada o test índice se comparó con la prueba de referencia o gold standard, si los pacientes fueron sometidos a ambas pruebas, si ambas pruebas se realizaron de forma próxima en el tiempo y si los resultados de las pruebas se midieron de forma ciega e independiente.
Una vez que la lectura crítica ha finalizado, es necesario extraer de forma resumida la información relevante de cada uno de los estudios, junto con los resultados o la conclusión alcanzada sobre la calidad de los mismos; para ello, se utilizan las denominadas tablas de síntesis de la evidencia. Aspectos básicos que estas tablas deben recoger son: la referencia bibliográfica, el tipo de estudio, el tamaño y las características de la muestra, la intervención y el comparador, los resultados obtenidos y las medidas de resultado, los comentarios del evaluador sobre las limitaciones y los sesgos del estudio, y la valoración final del mismo.
Tener recogida la información de cada uno de los estudios en forma de tablas permite resumir lo esencial de los mismos y poder compararlos entre sí.
Formulación de las recomendaciones
Finalmente, cuando ya se ha recabado y evaluado toda la evidencia relacionada con cada una de las preguntas PICO de la guía, el GEG ha de transformar y relacionar dicha evidencia en recomendaciones.
Actualmente, en nuestro medio se están simultaneando dos sistemas para llevar a cabo la formulación de recomendaciones. El primero de ellos es el sistema SIGN modificado, que está siendo reemplazado de forma paulatina por el sistema GRADE.
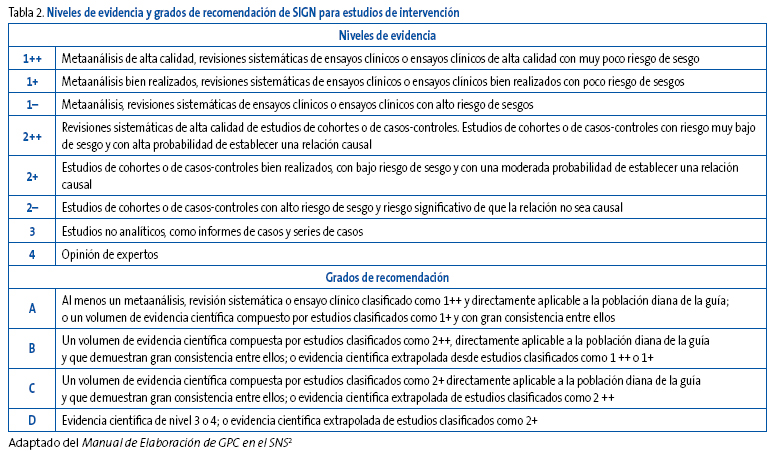
El sistema SIGN modificado clasifica y categoriza la evidencia de acuerdo con el diseño de estudio y con el riesgo de sesgos. Cada uno de estos niveles de evidencia se relaciona a posteriori con un determinado grado o fuerza de recomendación (Tabla 2).
Tabla 2. Mostrar/ocultar
Además de la calidad de la evidencia, el sistema SIGN considera que a la hora de formular las recomendaciones hay que tener en cuenta otros aspectos: cantidad y consistencia de la evidencia científica, generalización de los resultados a la realidad asistencial donde se pretende implementar la guía, aplicabilidad directa de los resultados a nuestra población diana e impacto clínico de las potenciales recomendaciones que el GEG pretenda formular.
El sistema SIGN ofrece la ventaja de ser un sistema conocido y relativamente sencillo; sin embargo, al igual que otros sistemas de clasificación y gradación de la evidencia, no está exento de limitaciones12; es por ello que, desde hace ya algún tiempo, distintas entidades internacionales como el SIGN y el NICE han comenzado a utilizar el sistema Grades of Recommendation, Assessment, Development and Evaluation (GRADE). Este sistema se caracteriza precisamente por intentar desligar la fuerza de las recomendaciones de la calidad de la evidencia. En el sistema GRADE, la idea fundamental es establecer el grado de confianza en el balance beneficio-riesgo de la intervención, el cual determina la fuerza de la recomendación. GRADE solo permite dos niveles de fuerza de la recomendación: fuerte o débil.
Así, por ejemplo, si el GEG confía en que los efectos beneficiosos de una intervención superan claramente los riesgos de la misma, o viceversa, el grado de la recomendación será fuerte a favor o fuerte en contra, respectivamente. Sin embargo, en las situaciones en las que el GEG no esté seguro, ya sea porque la evidencia es de baja calidad o porque el balance beneficio-riesgo esté muy equilibrado, la recomendación será débil a favor o débil en contra.
A la hora de establecer la fuerza de la recomendación, GRADE considera los siguientes factores: el balance beneficio-riesgo de la intervención, la calidad de la evidencia, la incertidumbre relacionada con los valores y preferencias de los pacientes, y el coste de la intervención.
El sistema de clasificación de la calidad de la evidencia que usa GRADE parte del diseño de estudio, de forma que los ECA conducen a evidencia de alta calidad, mientras que los estudios observacionales conducen a evidencia de baja calidad; ahora bien, GRADE considera cinco aspectos que pueden disminuir la calidad de la evidencia de un ECA: limitaciones en el diseño del estudio, resultados inconsistentes entre distintos ECA, evidencia indirecta, ausencia de precisión en los resultados y sesgo de publicación. Y tres aspectos que pueden aumentar la de una estudio observacional: magnitud del efecto grande y consistente entre distintos estudios observacionales, presencia de un gradiente dosis-respuesta y presencia de factores de confusión que podrían haber reducido la magnitud del efecto11.
La clasificación de la fuerza de la recomendación en dos categorías simplifica la toma de decisiones para los pacientes, los clínicos y los responsables de calidad. De esta forma, una recomendación fuerte para los pacientes implica que la mayoría de ellos desearía que las recomendaciones se implementasen; para los médicos, implica que la mayor parte de los pacientes deberían recibir las recomendación de la guía, y para los gestores y responsables de calidad, implica que en la mayoría de las situaciones las recomendaciones podrían adoptarse como indicadores de calidad. Mientras que una recomendación débil, en el caso de los pacientes, implica que la mayoría querría que la recomendación se implementase, pero otros muchos pacientes no lo querrían. En el caso de los médicos, implica ofrecer la recomendación de la guía pero teniendo presente que cada paciente puede requerir una elección distinta y que deberán ayudar al paciente a tomar una decisión teniendo en cuenta sus valores y preferencias. Y en el caso de los responsables de calidad, una recomendación débil implicará discutir con el equipo médico los pros y los contras de establecer la intervención recomendada como indicador de calidad11.
El sistema GRADE es un sistema exhaustivo que pretende solventar las limitaciones de los sistemas previos de clasificación de la evidencia y formulación de las recomendaciones, por un lado, haciendo explícito y transparente cada uno de los aspectos que el sistema exige tener en cuenta a la hora de formular las recomendaciones, y por otro, simplificando la clasificación de la fuerza de las recomendaciones.
Revisión externa
Una vez formuladas las recomendaciones y redactado el borrador de la guía, este ha de ser sometido a un proceso de revisión externa e independiente con el objeto de matizar, enriquecer y asegurar la exactitud de las recomendaciones2. Para ello, el borrador de la guía deber ser remitido a un grupo multidisciplinar de profesionales sanitarios. Es aconsejable que en la revisión externa también participen pacientes o representantes de pacientes para que revisen, si no toda la guía, al menos la parte de información dirigida a pacientes y familiares.
Tras el proceso de revisión, los comentarios recibidos habrán de ser revisados y valorados por los miembros del GEG, quienes en última instancia habrán de decidir si las aportaciones realizadas por los revisores han de ser o no incorporadas a la versión final de la guía.
LECTURAS RECOMENDADAS
- Guyatt G, Rennie D, Meade MO, Cook DJ. Users’ guides to the medical literature. A Manual for Evidence-Based Clinical Practice, 2.ª ed. New York: McGraw-Hill Medical; 2008.
- Grupo de trabajo sobre GPC. Manual metodológico. Madrid: Plan Nacional para el SNS del MSC. Instituto Aragonés de Ciencias de la Salud-I+CS; 2007 (Guías de Práctica Clínica en el SNS: I+CS; nº 2006/1) [en líonea]. Disponible en: http://portal.guiasalud.es/emanuales/elaboracion/index-02.html
BIBLIOGRAFÍA
- DiCenso A, Bayley L, Haynes RB. Accessing pre-appraised evidence: fine-tuning the 5S model into a 6S model. Evid Based Nurs. 2009;12(4):99-101.
- Grupo de trabajo sobre GPC. Elaboración de guías de práctica clínica en el Sistema Nacional de Salud. Manual metodológico. Madrid: Plan Nacional para el SNS del MSC. Instituto Aragonés de Ciencias de la Salud-I+CS; 2007. (Guías de Práctica Clínica en el SNS: I+CS; nº 2006/1).
- Committee on Standards for Developing Trustworthy Clinical Practice Guidelines, Board on Health Care Services, Institute of Medicine of the National Academies. Clinical practice guidelines we can trust. Washington DC: National Academy Press; 2011 [en línea] [consultado el 04-05-2012]. Disponible en: http://www.iom.edu/Reports/2011/Clinical-Practice-Guidelines-We-Can-Trust.aspx
- Atlas de variaciones en la práctica médica en el Sistema Nacional de Salud. Zaragoza: Instituto Aragonés de Ciencias de la Salud. 2005;1(1) [en línea] [consultado el 04-05-2012]. Disponible en: http://www.atlasvpm.org/avpm/
- Ministerio de Sanidad, Política Social e Igualdad. Plan Nacional de Calidad. Madrid: Ministerio de Sanidad y Consumo [en línea] [consultado el 05-05-2012]. Disponible en: http://www.msps.es/organizacion/sns/planCalidadSNS/ec_pnc05.htm
- GuíaSalud. Biblioteca de Guías de Práctica Clínica del Sistema Nacional de Salud. Guías de práctica clínica. Programa de elaboración de guías de práctica clínica en el Sistema Nacional de Salud. Zaragoza: Instituto Aragonés de Ciencias de la Salud; 2010 [en línea] [consultado el 05-05-2012]. Disponible en: http://portal.guiasalud.es/web/guest/gpc-sns
- Scottish Intercollegiate Guidelines Network. Clinical guidelines-numerical list. Edinburgh: SIGN; 2011 [en línea] [consultado el 05-05-2012]. Disponible en: http://www.sign.ac.uk/guidelines/published/numlist.html
- National Institute for Health and Clinical Excellence. NICE guidance by type. London: NICE; 2011 [en línea] [consultado el 05-05-2012]. Disponible en: http://guidance.nice.org.uk/Type
- Scottish Intercollegiate Guidelines Network. SIGN 50 A guideline developer’s handbook. Edinburgh: Scottish Intercollegiate Guidelines Network; 2008 [en línea] [consultado el 05-05-2012]. Disponible en: http://www.sign.ac.uk/guidelines/fulltext/50/index.html
- National Institute for Health and Clinical Excellence. The guidelines manual. London: National Institute for Health and Clinical Excellence; 2009 [en línea] [consultado el 05-05-2012]. Disponible en: http://www.nice.org.uk/media/5F2/44/The_guidelines_manual_2009_-_All_chapters.pdf
- Guyatt G, Rennie D, Meade MO, Cook DJ. Users’ guides to the medical literature. A Manual for Evidence-Based Clinical Practice, 2.ª ed. New York: McGraw-Hill Medical; 2008.
- Atkins D, Eccles M, Flottorp S, Guyatt GH, Henry D, Hill S, et al. GRADE Working Group. Systems for grading the quality of evidence and the strength of recommendations I: critical appraisal of existing approaches The GRADE Working Group. BMC Health Serv Res. 2004;22;4(1):38.
Cómo citar este artículo
. Form Act Pediatr Aten Prim. 2012;5;219-26