Enfermedad de Chagas. Cúando sospecharla y modo de actuación
2 Pediatra. CS Delicias. Málaga (España).
3 Pediatra. CS El Palo. Málaga (España).
4 MIR de pediatría. Hospital Materno Infantil. Málaga (España).
CASO CLÍNICO
Acude a la consulta de Pediatría una mujer de 32 años de origen boliviano, residente en España desde hace cinco años, con su hijo recién nacido, de una semana de vida. Tras revisar la cartilla de la madre descubrimos que durante el embarazo presentó serología positiva a enfermedad de Chagas.
Ante esta situación nos surgieron varias cuestiones: ¿qué significa exactamente una serología positiva a enfermedad de Chagas?, ¿qué síntomas debería tener la madre?, ¿puede transmitirse al bebé y con qué probabilidad?, ¿qué pruebas deberemos realizar?, y ¿qué tratamiento y pronóstico tiene?
IMPORTANCIA DEL TEMA
La enfermedad de Chagas, también conocida como tripanosomiasis americana, es una zoonosis endémica en América latina que forma parte de las 13 parasitosis o infecciones bacterianas conocidas como “grupo de enfermedades tropicales olvidadas”. Este conjunto de enfermedades causa al año aproximadamente 534 000 muertes. Fue descrita por Carlos Chagas en 1909. La importancia de dicha enfermedad radica en su alta morbimortalidad junto con las repercusiones socioeconómicas de la misma en estos países. El control y manejo de la enfermedad de Chagas ha mejorado mucho en las tres últimas décadas gracias a mejores medidas de prevención, y a un diagnóstico y un tratamiento más precoces, si bien es un problema que se ha incrementado en zonas no endémicas, como es el caso de España, debido a los movimientos migratorios y al desconocimiento de la misma, que hace que pase muchas veces desapercibida contribuyendo a su distribución.
EPIDEMIOLOGÍA
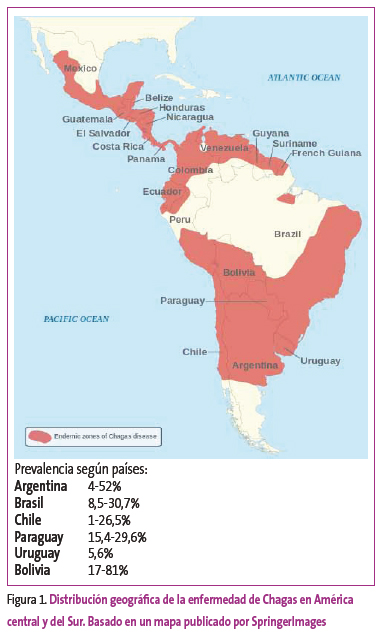
A pesar de las diferentes iniciativas promovidas por la Organización Panamericana de la Salud en los últimos años, la enfermedad de Chagas todavía constituye una amenaza para casi la cuarta parte de toda la población de América latina. Se estima que 25 millones de personas se encuentran en riesgo de adquirir la infección. Es endémica en 21 países, el número de personas infectadas es de diez millones, y se producen 41 200 nuevos casos anuales y 12 500 muertes (Figura 1).
Figura 1. Mostrar/ocultar
En cuanto a la infección congénita, se estima que habría cerca de dos millones de mujeres en edad reproductiva infectadas por Trypanosoma cruzi, de las que entre el 4 y el 8% transmitirían la infección al feto por vía transplancentaria y, consecuentemente, nacerían anualmente unos 15 000 niños con enfermedad de Chagas congénita.
Debido al aumento de la inmigración desde América al resto del mundo, la enfermedad de Chagas ha pasado de ser una endemia en dichos países a convertirse en un problema global, ya que se describen casos en un gran número de países por todo el mundo. España se ha convertido en los últimos años en un destino muy frecuente para los inmigrantes latinoamericanos.
AGENTE INFECCIOSO Y VÍAS DE TRANSMISIÓN
Agente infeccioso y vector
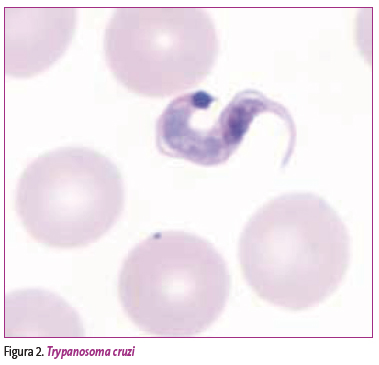
El Trypanosoma cruzi es agente causal de la enfermedad; se trata de un protozoo perteneciente a la familia Trypanosomatidae, que posee un cuerpo alargado con un flagelo que permite su movilización en el torrente circulatorio (Figura 2).
Figura 2. Mostrar/ocultar
El Trypanosoma cruzi pasa por diferentes etapas morfológicas (epimastigotes, amastigotes y tripomastigotes) en sus anfitriones vertebrados e invertebrados.
Vías de transmisión
-
Transmisión vectorial: es la principal vía de transmisión, en el 80% de los casos, a través de una chinche, conocida popularmente como la vinchuca (Figura 3).
Figura 3. Mostrar/ocultar
Estos insectos tienen un hábitat peridoméstico en áreas rurales, preferentemente en las hendiduras de muros de barro y en los techos de hojas de palma. Tras picar al paciente y alimentarse de su sangre, las chinches defecan en la superficie cutánea adyacente, produciéndose la infección a través de la contaminación de la herida de la picadura con las deyecciones infectadas. - Vía trasplacentaria: se produce cuando la madre tiene infección tanto aguda como crónica. Su transmisión depende del grado de parasitación materna, del grado de inmunidad materna y de factores placentarios.
- Por leche materna: aunque raramente, existe tal posibilidad. No debemos desaconsejar la lactancia exponiendo al niño a la desnutrición, el nivel socioeconómico siempre será valorado en esta recomendación.
- Por hemotransfusión: la sangre proveniente de donadores con infecciones ignoradas genera cuadros clínicos agudos en los receptores, incluso muerte fulminantes. El riesgo de transmisión es aún mayor con la transfusión aislada de plaquetas. También sería posible la misma en los trasplantes de órganos sólidos y de médula ósea.
-
Por contaminación accidental en laboratorio.
- Por comida contaminada por T. cruzi: forma muy rara, aunque posible, de transmisión.
FORMAS CLÍNICAS
Enfermedad de Chagas congénita
Pueden presentarse síntomas ya desde el periodo intrauterino como son la placentitis y el aborto.
Es sintomática solo en un 20% de los casos. Según el tiempo de aparición de los síntomas, puede ser:
- Precoz <30 días: prematuridad y sepsis.
- Tardía >30 días: hepatomegalia: con o sin hiperbilirrubinemia. Alteraciones cardiacas: miocarditis chagásica, taquicardia intensa, aplanamiento de la onda T y alargamiento de los tiempos de conducción. Alteraciones hematológicas: leucopenia, plaquetopenia y anemia microcítica normocrómica. Alteraciones del sistema nervioso central: irritabilidad, meningitis, encefalitis, hipotonía inespecífica, microcefalia. Existen calcificaciones cerebrales en el 30% de los pacientes sintomáticos. Alteraciones oftalmológicas: coriorretinitis, opacificación del cuerpo vítreo. Alteraciones pulmonares: neumonitis, distrés respiratorio. Alteraciones digestivas: megacolon, megaesófago.
Sin embargo, en muchos casos no se encuentra sintomatología en el primer año de vida, el paciente pasa a la fase indeterminada (asintomática), pudiendo aparecer la sintomatología posteriormente.
Enfermedad Chagas pediátrica
Fase aguda
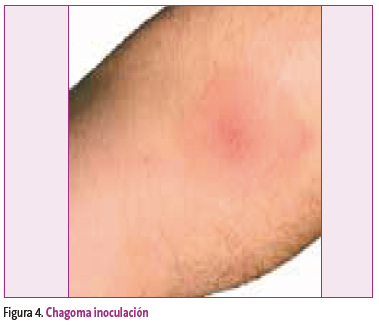
Es generalmente oligosintomática, con febrícula, mialgias, adenitis y hepatomegalia (que puede persistir durante más de seis meses). Suele ser típico de esta fase un nódulo cutáneo local llamado chagoma, que aparece en el sitio de inoculación (Figura 4).
Figura 4. Mostrar/ocultar
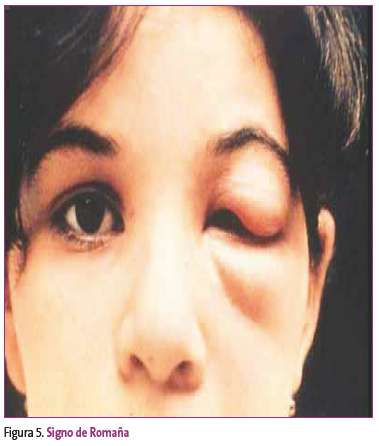
Se observa habitualmente en partes del cuerpo descubiertas. Es de tamaño variable, hiperpigmentado, tomando a veces el tinte simple de una mácula rosada, y otras se asemeja a un proceso piógeno. Es poco o nada doloroso. Este chagoma desaparece entre los 30 y los 60 días de la enfermedad pero el parásito sigue en la sangre. Cuando el lugar de inoculación es la membrana mucosa conjuntival, el paciente puede desarrollar edema periorbital unilateral, conjuntivitis y linfadenitis preauricular. Esta constelación de manifestaciones se denomina signo de Romaña, presente en muy pocos casos (Figura 5).
Figura 5. Mostrar/ocultar
Si bien es cierto que hasta el 90% de los pacientes en esta fase curan incluso sin tratamiento.
En las formas más graves, en pacientes inmunodeprimidos, tratamientos con inmunosupresores prolongados, tumores, trasplantes o en infectados por el virus de la inmunodeficiencia humana (VIH) puede presentarse como meningoencefalitis en un 79% de los casos, o miocarditis en aproximadamente un 25%. Se produzca o no la reactivación de la enfermedad, los pacientes que presentan coinfección por virus VIH y T. cruzi tienen parasitemias mucho mayores que el resto de la población infectada.
Fase indeterminada
Suele ser asintomática, en esta fase permanecen el 70% de los pacientes toda su vida. Se caracteriza por presentar anticuerpos anti T. cruzi positivos pero sin sintomatología alguna, con electrocardiograma (ECG) y radiografía de tórax normales.
Fase crónica
Aparece en el 30% de los pacientes infectados tras 10-20 años de parasitación. La enfermedad afecta al sistema nervioso, al sistema digestivo y al corazón. Las principales formas clínicas son:
- Cardiopatía chagásica crónica: cuadro clínico más precoz y potencialmente más grave. En sus fases iniciales es asintomática, evidenciándose por alteraciones en el ECG; bloqueo auriculoventrcular, extrasístoles ventriculares repetidas, bradicardias inferiores a 40 lpm o taquiarrítmias supraventriculares. Por el contrario, en su fase evolucionada, se caracteriza por una cardiopatía dilatada fibrosante con tendencia a la afectación segmentaria del miocardio y de gran potencial arritmogénico. Así mismo, son característicos los aneurismas ventriculares apicales, fenómenos tromboembólicos sistémicos (fundamentalmente accidentes cerebrovasculares isquémicos) y el dolor precordial indistinguible de una cardiopatía isquémica. Cuando existe clínica de insuficiencia cardiaca, esta suele ser de predominio derecho o congestivo. Es la primera causa de insuficiencia cardiaca en áreas endémicas, siendo su principal complicación la muerte súbita.
-
Afectación crónica del tubo digestivo: ocurre de forma aislada o asociada a la cardiopatía en aproximadamente el 10% de los pacientes con enfermedad crónica. La forma más característica es la de los “megasíndromes” (megaesófago y, menos frecuente, megacolon):
- Megaesófago: altera la motilidad esofágica produciendo disfagia, regurgitación y dispepsia, su máxima expresión es la acalasia.
- Colopatía chagásica, megacolon: cuadro clínico más tardío. Afecta principalmente al recto y al sigma, produciendo clínica de estreñimiento, distensión abdominal, formación de vólvulos y perforación.
DIAGNÓSTICO
Al intentar diagnosticar a un paciente con enfermedad de Chagas, lo primero que debemos saber es cuándo sospecharla.
- Todo adulto o niño procedente de país endémico de enfermedad de Chagas y que nunca haya sido estudiado, independientemente del tiempo transcurrido desde que dejó de vivir en la zona endémica.
- Todo hijo de madre latinoamericana no estudiada, independientemente de la edad que tenga.
- Personas que realicen viajes frecuentes a países endémicos o hayan vivido allí por una temporada.
Existen métodos de diagnóstico directos e indirectos; el uso de uno u otro depende del momento de la enfermedad. Así, el neonato será en fase aguda y la madre se encontrará en fase crónica normalmente.
La fase aguda se caracteriza por una parasitemia patente, generalmente en los primeros dos meses tras la infección; transcurridos estos, la tasa de parasitemia disminuye y será necesario usar los anticuerpos anti T. cruzi para el diagnóstico.
Métodos directos
Consisten en la detección del parásito o parte del mismo.
- Microhematocrito: se realiza en sangre del cordón. Consiste en identificar el movimiento característico de los parásitos en la interfase entre el paquete de hematíes y el plasma de cuatro a seis capilares. La sensibilidad de este procedimiento es próxima al 100% y su límite de detección son 40 parásitos/ml de sangre.
- Examen en fresco: visualización del parásito en sangre mediante tinciones, es útil cuando existe una parasitemia elevada.
- Diagnóstico molecular: reacción en cadena de la polimerasa (PCR) para detección de ADN del T. cruzi. La sensibilidad analítica es de 1 parásito/ml de sangre. Parasitemias menores solo son detectables cuando se analizan volúmenes mayores a 5 ml de sangre.
Son pruebas muy específicas pero de baja sensibilidad en las fases no parasitémicas de la enfermedad. Deben utilizarse en la fase aguda.
Métodos indirectos (serología)
Consisten en la detección de anticuerpos contra T. cruzi:
- Técnicas de análisis de inmunoabsorción ligada a las enzimas (ELISA) e inmunofluorescencia indirecta (IFI) con antígenos totales.
- Test rápidos basados en inmunocromatografía y aglutinación (sensibilidad variable, continúan en evaluación).
Las técnicas de ELISA destacan por su sensibilidad, pero poseen baja especificidad, por lo que si es negativa podremos descartar infección, pero si es positiva necesitará confirmación mediante otra técnica diagnóstica, como IFI, precisando la positividad de las dos pruebas serológicas para hacer el diagnóstico. Las técnicas de diagnóstico indirecto deben utilizarse como prueba de cribado de la fase indeterminada, así como en pacientes en fase crónica.
Un problema importante de los ensayos serológicos es la reactividad cruzada con otras enfermedades como la leishmaniasis.
Como en la etapa crónica las parasitemias son menores de 10 parásitos/ml, la detección de ADN del parásito mediante PCR es una prueba complementaria al diagnóstico serológico, es definitoria solo si es positiva.
SCREENING EN EMBARAZADAS Y EN EL RECIÉN NACIDO
¿Por qué es importante?
- El riesgo de transmisión de madre a hijo del parásito existe, aunque ya no se encuentren en zona endémica.
- La tasa de enfermedad de Chagas es elevada en países como Bolivia, Argentina y Paraguay.
- La detección del T. cruzi es sencilla.
- Las tasas de curación en neonatos alcanzan el 100%.
- El no tratamiento conlleva a la cronificación, el mantenimiento de portadores reservorios y la posibilidad de desarrollar la enfermedad en 30-40 años en un tercio de los casos.
Población diana
- Embarazadas procedentes de Latinoamérica.
- Embarazadas que han vivido allí por un tiempo.
- Hijos de estas madres aunque ellas nunca hayan vivido allí.
¿Cuándo realizar el screening?
En cualquier momento es posible, aunque idealmente en el primer trimestre. Sino se hubiera realizado durante el embarazo se hará producido el parto.
¿Cómo realizarlo?
Se realizará estudio serológico de dichas mujeres. Se necesitarán dos serologías positivas con diferentes métodos ELISA e IFI y a diferentes antígenos para considerar a la madre infectada. Si la serología es positiva es conveniente realizar una PCR para evaluar su parasitemia y su tratamiento para prevenir el riesgo de transmisión en los siguientes embarazos.
¿Y al recién nacido?
Debemos esperar al nacimiento, ya que el diagnóstico usando el líquido amniótico es difícil, solo el 25% de los niños con enfermedad de Chagas congénita tienen parásitos en el mismo.
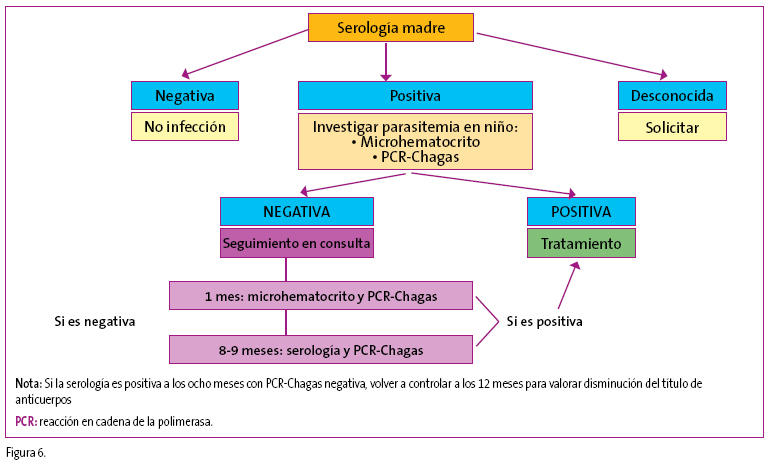
A todo hijo de madre con serología positiva o con madre procedente de país endémico no estudiada, lo que la hace posible infectada, se le solicitará en las primeras 48 horas de vida, microhematocrito de sangre de cordón y PCR en sangre periférica (Figura 6).
Figura 6. Mostrar/ocultar
- Si ambas pruebas son positivas: se ha producido la infección congénita y debe instaurarse el tratamiento específico (a veces si la transición se ha producido en el parto, puede ser difícil la detección en el primer microhematocrito realizado en las primeras 48 horas de vida).
- Si son negativas: se repetirán las dos pruebas (microhematocrito y PCR-Chagas) al mes de vida.
Si al mes de vida estas pruebas son:
- Positivas: se habrá producido infección y se producirá al tratamiento.
- Negativas: se procederá a la evaluación de la serología a los ocho meses de edad, ya que para entonces los anticuerpos maternos se habrán negativizado en la mayoría de los casos.
Si no se encuentran anticuerpos podremos asegurar que no se ha producido infección y detener en este momento nuestro seguimiento. Si, por el contrario, se evidenciara serología positiva, cabe la posibilidad de que la negativización de los anticuerpos no ocurre hasta por encima de los 12 meses, por lo que es importante valorar el título de anticuerpos del que se partía para poder valorar si la infección va controlándose o por el contrario la tasa de anticuerpos va en ascenso pudiendo hablar en este caso de infección.
Se considerará que todo niño hijo de madre con enfermedad de Chagas está infectado si el examen parasitológico es positivo para T. cruzi o se detectan anticuerpos para T. cruzi después de los 8-9 meses de edad, con independencia de que esté o no sintomático.
Las pruebas complementarias que deben realizarse en caso de que se confirme la transmisión de la infección son:
- Radiografía de tórax.
- ECG, ecocardiografía.
- Ecografía cerebral y de abdomen.
- Fondo de ojo, potenciales evocados.
- Radiografía y ecografía de abdomen.
No está contraindicada la lactancia salvo que haya grietas en el pezón importantes con sangrado activo.
TRATAMIENTO
El tratamiento está recomendado en todos los casos de infección aguda, infección congénita y de reactivación de la misma. También en todos los niños menores de 18 años con infección crónica y en los adultos entre 19 y 50 años sin signos de cardiopatía chagásica crónica. En los mayores de esta edad el tratamiento será opcional, dado que el índice beneficio/toxicidad del fármaco no es favorable. No se deberá administrar tratamiento a pacientes con cardiomiopatía chagásica desarrollada, sino ofrecer tratamiento de soporte de las complicaciones de la misma.
No se dispone de estudios concluyentes que indiquen que el tratamiento en la fase indeterminada resulte eficiente para evitar su cronificación.
En la actualidad hay dos tratamientos efectivos: el benznidazol y el nifurtimox.
Los fármacos utilizados, su mecanismo de acción y sus principales efectos adversos se describen en la Tabla 1.
Tabla 1. Mostrar/ocultar
La tasa de éxito tras el tratamiento depende de la fase de la enfermedad en la que se haya realizado. En la fase aguda alcanza tasas de curación muy elevadas, no así en la fase crónica:
- En menores de tres años alcanza casi el 100%.
- Entre los 6 y los 12 años baja al 62-56%.
- En el adulto solo alcanza el 8-25%.
Se considera efectiva cuando se objetivan las tres situaciones siguientes:
- Disminución progresiva de los títulos de anticuerpos hasta su desaparición en los 2-3 años posteriores a la finalización del tratamiento.
- Negativización de la PCR o el microhematocrito, con posterior descenso de los anticuerpos hasta desaparecer.
- Desaparición de las alteraciones electrocardiográficas en pacientes con cardiopatía chagásica, independientemente de los títulos de anticuerpos.
Tras el tratamiento, deberemos evaluar su eficacia comprobando la eliminación del parásito:
- Antes de los seis meses se determina por la negativización del microhematocrito y la PCR.
- Realizaremos serología cada 3-6 meses, viendo la tendencia de los anticuerpos anti T. cruzi. La tendencia de la cinética de anticuerpos debe ser hacia la negativización, que es patente desde los 12-24 meses después del tratamiento. La persistencia de anticuerpos durante más de tres años, en una infección congénita tratada en el primer año, debe considerarse fracaso del tratamiento. Si esto sucede, habría que volver a tratar, aunque este hecho es muy raro y debe valorarse cada caso de forma individual.
El benzinidazol y el nifurtimox están contraindicados en el embarazo y en pacientes con disfunción renal o hepática grave.
DISCUSIÓN
La enfermedad de Chagas exige un alto índice de sospecha por parte de los médicos y pediatras de Atención Primaria, dado su curso clínicamente silente en muchos de los casos. Ante un niño inmigrante o hijo de este, especialmente si proceden de área endémica, deberemos realizar una anamnesis minuciosa sobre los antecedentes epidemiológicos (hábitat rural en casas de barro y adobe, transfusiones sanguíneas) y familiares o de su entorno inmediato (muerte súbita, cardiopatía), además de una exploración física buscando signos y síntomas característicos. Es necesario determinar la serología a posibles pacientes infectados, especialmente en embarazadas, para evitar la propagación vertical de la enfermedad. Como pediatras, debemos estar alerta sobre aquellos niños nacidos de madres procedentes de dichos países, puesto que un diagnóstico y tratamiento precoces conllevan una tasa de curación próxima al 100%.
BIBLIOGRAFÍA RECOMENDADA
- Bern C, Montgomery S, Herwaldt B, Rassi A, Marín-Nieto JA, Dantas RO, et al. Evaluation and treatment of Chagas disease in the United States: a systemic review. JAMA. 2007;298(18):2171-81.
- Coura JR, Pinto Dias JC. Epidemiology, control and surveillance of Chagas disease-100 years after its discovery. Mem Inst Oswaldo Cruz. 2009;104(1):31-40.
- Gascón J. Conferencia de Consenso. Diagnóstico y tratamiento de la enfermedad de Chagas importada. Med Clin (Barc). 2005;125(6):230-5.
- González-Toméa MI, Rojosa P, Flores-Chávezb M. Sociedad de Infectología Pediátrica. Enfermedad de Chagas. Prevención de la infección en el recién nacido. An Pediatr Contin. 2008;6(6):369-74.
- Hotez PJ, Molyneux DH, Fenwick A, Kumaresan J, Sachs SE, Sachs JD, et al. Control of neglected tropical diseases. N Engl J Med. 2007;357:1018-27.
- Hotez PJ. Stigma: The Stealth Weapon of the NTD. Plos Negl Trop Dis. 2008;2(4):e230.
- Rassi A Jr, Rassi A, Marin-Neto JA. Chagas disease. Lancet. 2010;375:1388-402.
- Rivero Cuello M, Hagerman Sánchez A, Núñez Cuadros E. Enfermedad de Chagas. En: Jurado A, Urda AL, Núñez E. Guía esencial de Diagnóstico y Terapéutica en Pediatría, 1.ª ed. Madrid: Editorial Médica Panamericana; 2011. p. 457-63.
- Sartori AM, Ibrahim KY, Nunes Westphalen EV, Braz LMA, Oliveira OC, Gakiya E, et al. Manifestations of Chagas disease (American trypanosomiasis) in patients with HIV/AIDS. Annals of Tropical Medicine & Parasitology. 2007;101(1):31-50.