Estudios experimentales. Ensayo clínico aleatorizado
2 Pediatra. CS Delicias. Miembro del Grupo de Investigación de la AEPap. Málaga (España).
RESUMEN
En la investigación clínica, se reconocen dos tipos de diseños analíticos: los experimentales (ensayos clínicos y los observacionales. La diferencia radica en que, en los experimentales, el investigador interviene en la asignación de la exposición a un determinado agente1.
Al tratarse de investigación en seres humanos, y aún más cuando se realiza en niños, es muy importante diseñar los estudios de acuerdo con los estándares científicos aceptados, tanto éticos como metodológicos2.
El conocimiento de la correcta elaboración de un estudio experimental trasciende el mero interés de la investigación clínica, para contribuir a desarrollar un sentido crítico en los lectores, permitiendo una mejor valoración de los resultados publicados3-5.
Para aumentar la transparencia en la investigación clínica, el registro de libre acceso para los ensayos clínicos aleatorizados (ECA) a su inicio (http://clinicaltrials.com) y la publicación de los resultados de los ensayos clínicos (EC) deberían ser obligatorios a escala mundial, lo cual contribuiría a evitar el sesgo de publicación, debido a la difusión de los resultados favorables y a la supresión de los resultados negativos6,7.
La declaración CONSORT ha supuesto un gran avance para que la publicación de los ensayos clínicos aleatorizados (ECA) sea más rigurosa y recoja de forma adecuada los aspectos metodológicos.
Los ensayos clínicos aleatorizados con un diseño y un desarrollo apropiados constituyen el “patrón oro” en la evaluación de las intervenciones en los cuidados sanitarios8.
Resulta de vital importancia establecer módulos y programas de investigación durante la licenciatura, en la formación especializada y durante la carrera profesional7.
PUNTOS CLAVE
- Muchos de los problemas de salud o motivos de consulta que atiende el pediatra de atención primaria no se han investigado satisfactoriamente y está en nuestra mano orientar la investigación clínica hacia donde existen incertidumbres relevantes desde el punto de vista clínico.
- Los estudios experimentales, o cualquier otro estudio, deben responder a preguntas que contemplen los intereses clínicos de los pacientes y del sistema sanitario, en lugar de otro tipo de intereses.
- El ECA es el método más riguroso y válido para la evaluación de la efectividad de las terapias médicas.
- Para aumentar la transparencia en la investigación clínica, el registro y la publicación de los resultados de los EC deberían ser de obligado cumplimiento a escala mundial.
- La declaración CONSORT (Consolidated Standars of Reporting Trials) ha supuesto un avance importante para que la publicación de los ECA recoja de forma adecuada los aspectos metodológicos.
TIPOS DE ESTUDIOS EXPERIMENTALES
El diseño experimental más importante es el ECA, sobre el que hablaremos posteriormente, pero también existen otros tipos de estudios experimentales.
Kenneth J. Rothman9 considera entre los estudios experimentales:
- Ensayos de campo.
- Ensayos comunitarios de intervención.
- Ensayos clínicos.
Ensayo de campo o prueba10
Se realiza sobre sujetos sanos o en riesgo de adquirir la enfermedad, y estudia factores preventivos, como es el caso de la administración de vacunas, o el seguimiento de dietas10. Generalmente, se utilizan para el estudio de enfermedades muy frecuentes o muy graves. La intervención se realiza de modo que los sujetos son aleatorizados de forma individualizada a los diferentes grupos de estudio. La información se recoge sobre la comunidad misma, en el ambiente epidemiológico natural de los sujetos, sin necesidad de una institución cerrada específica para realizar el estudio.
Ensayos comunitarios o de intervención
Son estudios experimentales que se emplean para probar hipótesis. Se realizan, al igual que el ECA, sobre un grupo experimental y uno de control, aunque la diferencia con este radica en que los grupos de intervención y control no son individuos elegidos al azar, sino comunidades completas. La asignación a los grupos no es aleatoria, sino que se eligen comunidades enteras por razones de conveniencia del investigador, o de las autoridades interesadas en el estudio. Estos grupos de participantes representan a menudo conjuntos de tipo administrativo o sanitario y su tamaño puede ser el de familias, hospitales o grupos comunitarios enteros11. Son diseños buenos para probar hipótesis de intervenciones educativas, para evaluar sistemas de gestión y organización de la atención médica, o para abordar enfermedades crónicas no transmisibles asociadas a condiciones socioculturales o a estilos de vida1.
Ensayo clínico
Definición
Un EC es una evaluación experimental de un producto, sustancia, medicamento, técnica diagnóstica o terapéutica que, a través de su aplicación a seres humanos, pretende valorar su eficacia y seguridad.
Normativa
Los EC se deben realizar en condiciones de respeto a los derechos fundamentales de la persona y a los postulados éticos que afectan a la investigación biomédica12. En España, se establece que ningún EC podrá realizarse sin el informe previo favorable de un Comité de Ética de la Investigación (CEI), que será independiente de los promotores e investigadores y de las autoridades sanitarias. De forma detallada, P. Gorrotxategui13 , en un artículo recientemente publicado en FAPap, aporta los aspectos éticos fundamentales para llevar a cabo la investigación biomédica, considerando la normativa vigente hasta el momento de su publicación.
Es importante valorar la posible aparición de efectos adversos o peligrosos y, en este sentido, cabe destacar la importancia de las medidas que protegen a los niños de experimentaciones poco éticas, sin menoscabo de las actuaciones que permitan avances en la terapéutica pediátrica14.
La realización de ensayos clínicos en Atención Primaria, debido a su elevado coste, al tiempo que requieren y a las barreras éticas, deben contemplarse bajo el auspicio de un organismo que permita una participación multicéntrica.
Aportamos algunos datos publicados recientemente, relacionados con la normativa en referencia a los ensayos clínicos en seres humanos:
-
Cuando los EC de fase II a IV, o los de fase I que incluyan población pediátrica, dispongan del dictamen favorable del CEI y la autorización de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), serán publicados en el Registro Europeo de Ensayos Clínicos.
A finales de marzo de 2011 comenzó a funcionar en Europa el Registro Europeo de Ensayos Clínicos (EU Clinical Trials Register), que permite que un EC con medicamentos realizado en Europa quede registrado sin la necesidad de un esfuerzo adicional al propio proceso de aprobación del estudio6. - A partir de noviembre de 2012, la AEMPS comenzó a aplicar la firma y notificación electrónica de las resoluciones referentes a solicitudes de autorización de ensayos clínicos tramitadas conforme al Real Decreto 223/2004, así como de los oficios relacionados con este trámite (www.aemps.gob.es/informa/notasInfo).
Clasificación
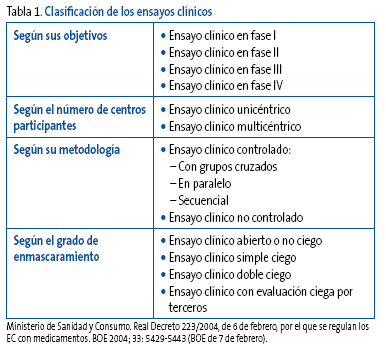
Los EC pueden clasificarse en función de distintos criterios15 (Tabla 1).
Tabla 1. Mostrar/ocultar
Tipos de ensayos clínicos según sus objetivos
De acuerdo con los objetivos perseguidos y la información disponible, se distinguen los siguientes tipos de EC:
Ensayos clínicos en fase I
Constituyen el primer paso en la investigación de una sustancia o medicamento nuevo en el hombre. Son estudios de farmacocinética y farmacodinámica que proporcionan información preliminar sobre el efecto y la seguridad del producto en sujetos sanos, o en algunos casos en pacientes, y orientan la pauta de administración más apropiada para ensayos posteriores.
En esta fase también se realiza la denominada prueba de concepto, para determinar si existen indicios razonables de que el fármaco pueda ser eficaz para la indicación seleccionada. Si el fármaco se considera razonablemente seguro para el hombre, pasará a la fase II.
Ensayos clínicos en fase II
Representan el segundo estadio en la evaluación de una nueva sustancia o medicamento en el ser humano. Se realizan en pacientes que padecen la enfermedad o entidad clínica de interés. Tienen como objetivo:
- Proporcionar información preliminar sobre la eficacia del producto.
- Establecer la relación dosis-respuesta del mismo.
- Conocer las variables empleadas para medir eficacia.
- Ampliar los datos de seguridad obtenidos en la fase I.
Por lo general, estos EC son controlados y con asignación aleatoria a los tratamientos.
Una vez probada la eficacia a corto plazo, el fármaco pasa a la fase III.
Ensayos clínicos en fase III
Son EC destinados a evaluar la eficacia y seguridad del tratamiento experimental intentando reproducir las condiciones de uso habituales y evaluando la relación beneficio/riesgo en comparación con otras alternativas terapéuticas disponibles en la indicación estudiada. Se realizan en una muestra de pacientes más amplia (de 1000 a 3000 pacientes) que en la fase anterior y representativa de la población general a la que iría destinado el medicamento. Estos estudios son preferentemente controlados y aleatorizados. Si el fármaco logra superar todas estas fases se lanza al mercado, y a partir de aquí entraría en una fase IV.
Ensayos clínicos en fase IV
Son EC que se realizan con un medicamento después de su comercialización e incluyen la farmacovigilancia. Estos ensayos pueden ser similares a los descritos en las fases I, II y III si estudian algún aspecto aún no valorado o condiciones de uso distintas de las autorizadas, como podría ser una nueva indicación. Estos estudios son preferentemente controlados y aleatorizados.
A veces en Atención Primaria se ofrece la colaboración para participar en la fase última del estudio, cuando llega el momento de administrar las muestras. Se deben tener en cuenta detalles tan nimios como la presentación de estas, ya que el simple formato del envase puede generar rechazo.
Tipos de ensayos clínicos según su metodología
Ensayo clínico controlado
Existe una comparación con un grupo control o testigo. El EC controlado aleatorizado incluye al menos dos grupos de voluntarios, pacientes o sanos, cuya asignación a un tratamiento experimental o control se realiza al azar, de forma que ni el sujeto ni el médico responsable de su selección o tratamiento puedan influir en su asignación. Tanto la selección de sujetos como los periodos de tratamiento y seguimiento han de tener lugar simultáneamente en todos los grupos. En la gran mayoría de los casos es la única forma científicamente válida para evaluar la eficacia y seguridad de una intervención terapéutica. Estos ensayos pueden ser:
- EC con grupos cruzados: los tratamientos, experimental y control, son administrados a cada individuo en periodos sucesivos, determinados aleatoriamente, lo que permite a cada sujeto ser su propio control.
- EC con grupos paralelos: uno o varios grupos de sujetos son asignados para recibir el tratamiento experimental al mismo tiempo que otro grupo recibe el tratamiento control.
- EC secuencial: es aquel en el que, poniendo a prueba una hipótesis específica, el número de sujetos no está prefijado de antemano, sino que depende de los resultados que se van obteniendo a lo largo del mismo.
Ensayo clínico no controlado
Es el que no comporta una comparación con un grupo control o testigo.
ENSAYO CLÍNICO ALEATORIZADO
Definición
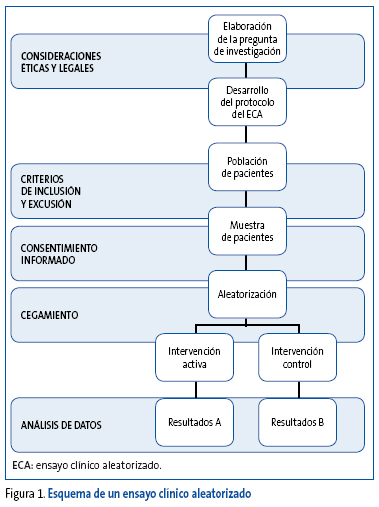
Un ECA es un experimento planificado en el que, de forma prospectiva, se comparan dos o más intervenciones preventivas, curativas o rehabilitadoras, asignadas de forma individualizada y aleatoria a un grupo de pacientes, con el objetivo de estudiar la eficacia y/o seguridad de dichas intervenciones en el ser humano. Tanto la selección de los sujetos como los periodos de tratamiento y seguimiento han de tener lugar simultáneamente en todos los grupos (grupos de intervención y grupos control)1 (Figura 1).
Figura 1. Mostrar/ocultar
El ECA en su forma más sencilla es un estudio de diseño paralelo con dos grupos, que consiste en la selección de una muestra de pacientes y su asignación de forma aleatoria a uno de los dos grupos. Uno de ellos recibe la intervención de estudio y el otro la de control utilizada como referencia o comparación. Ambos grupos se siguen de forma concurrente durante un periodo determinado, cuantificando y comparando las respuestas observadas en ambos.
El valor de este diseño en el campo de la biomedicina se aprecia, por ejemplo, al observar que la mayoría de las recomendaciones terapéuticas y guías de práctica clínica se basan en las pruebas proporcionadas por ECA; además, las autoridades sanitarias obligan a la realización de un ECA para demostrar la eficacia y seguridad de un nuevo fármaco antes de su comercialización. Este tipo de diseño nos acerca, de forma más directa, a la noción de causalidad entre una intervención y unos resultados concretos10.
Metodología
Selección de los participantes y tamaño de la muestra
El sujeto o participante de un ECA es la persona sana o enferma que participa en él, después de haber otorgado libremente su consentimiento informado (CI).
La definición del objetivo del ensayo hace referencia a la población diana a la que se desea poder extrapolar los resultados. Sin embargo, el estudio se lleva a cabo sobre una población definida por unos criterios de selección especificados a priori (población experimental), de la que se obtendrán los sujetos que finalmente participarán en el ensayo.
La utilización de criterios de inclusión y exclusión estrictos conduce a la obtención de una muestra homogénea, lo que aumenta la validez interna del estudio, pero que, al alejar la población de estudio de la diana, limita su capacidad de generalización o extrapolación.
Por otro lado, si se definen criterios muy amplios, la población de estudio será más representativa de la diana y las posibilidades de generalizar los resultados serán mayores pero, al ser más heterogénea, será más difícil detectar una respuesta al tratamiento y se requerirá un mayor número de individuos.
La determinación de un tamaño muestral adecuado pretende dotar a la muestra del poder estadístico suficiente para que si existen diferencias no debidas al azar entre los dos grupos puedan detectarse. Para ello, además de tener en cuenta la homogeneidad de las poblaciones participantes, es necesario valorar la cuantía de las diferencias que se pretende poner de manifiesto, los errores de tipo I y II que se consideran aceptables y la proporción esperada de pacientes que abandonarán el estudio. Así pues, la decisión sobre el tamaño de la muestra es muy importante. Una muestra demasiado grande implica un gasto excesivo de recursos, y por el contrario, una muestra demasiado pequeña disminuye la utilidad de los resultados.
Es imprescindible calcular el tamaño necesario de la muestra según los objetivos del estudio, el diseño planteado y el tipo de variables, así como decidir qué técnica de muestreo se utilizará para seleccionar a los sujetos16.
El muestreo es el proceso que permite extraer una muestra de una población y facilitará realizar inferencias sobre una población, estudiando una muestra extraída de ella.
Los errores o sesgos en la recogida de la muestra pueden desautorizar los resultados, al no ser totalmente representativa de la población a estudiar.
Tras la elección de una muestra representativa, se procede a realizar la propuesta de participación a los sujetos integrantes, así como a la presentación del consentimiento informado (CI) requisito fundamental para poder ser incluido en el ensayo. Todo estudio de investigación en el ámbito clínico debe, según la normativa, incluir un documento de CI, el cual consta de una Hoja de Información al Paciente (HIP) y del documento donde este deberá aceptar con su firma la participación en el estudio13,17.
Asignación aleatoria. Sesgo de selección
La fortaleza principal de un EC es la adecuada aleatorización. Consiste en la asignación de los sujetos participantes a los diferentes grupos de intervención por un mecanismo únicamente debido al azar, de modo que ni el investigador ni el sujeto pueden influir y no conocen el grupo al que son asignados.
Permite una distribución equilibrada de las características de los pacientes a los grupos de tratamiento, generando grupos comparables respecto a cualquier condición conocida o no –variables de confusión– que pudiera afectar al resultado; así, la diferencia principal entre los grupos será la intervención recibida. Permite crear grupos similares al inicio del ensayo, en cuanto al riesgo de presentar el evento que se espera modificar con la intervención.
La eficacia de la aleatorización depende del tamaño muestral del estudio; así, en muestras pequeñas, aunque sean adecuadamente aleatorizadas, existen más posibilidades de que la distribución de las características de los grupos de intervención no sea totalmente homogénea.
La asignación aleatoria, cuando se realiza con un tamaño muestral adecuado, equilibra los grupos respecto de los factores pronósticos que puedan determinar un mayor o menor riesgo de presentar el resultado, ya sean conocidos o no18.
Existen diferentes métodos de aleatorización, aunque los más frecuentemente empleados son la aleatorización simple, la aleatorización por bloques y la aleatorización estratificada.
Un ejemplo de aleatorización simple sería lanzar una moneda al aire, o de forma más sofisticada, el empleo de tablas de números aleatorios, o la generación de números aleatorios mediante un programa informático. Son sistemas sencillos, pero en muestras pequeñas no garantizan el equilibrio en el tamaño de los grupos ni la distribución homogénea de los factores de confusión. Estos problemas se resuelven utilizando la aleatorización por bloques, en la que se definen bloques de sujetos de un tamaño predeterminado en los que, por diseño, se fuerza a que el número de sujetos asignado a cada una de las intervenciones en estudio sea igual. Una vez constituidos los bloques, se aleatorizan uno a uno los sujetos de cada bloque.
En la aleatorización estratificada se definen previamente los factores pronósticos por los que se desea estratificar (por ejemplo, sexo: hombre/mujer, y estado civil: soltero/casado/separado/viudo). Se constituyen tantos estratos como el producto del número de categorías de cada uno de los factores considerados. Cada vez que se incorpora un nuevo sujeto al estudio se le asigna directamente a su estrato correspondiente (mujer soltera), y dentro de cada estrato se realiza un proceso de aleatorización independiente.
Además de la posibilidad de homogeneizar los grupos, evitando que sean otras variables diferentes de la intervención las que condicionen los resultados obtenidos, la aleatorización permite utilizar técnicas de enmascaramiento para evitar el denominado sesgo de selección. Este sesgo ocurre cuando, o bien el investigador encargado de realizar la asignación o bien el sujeto tienen alguna influencia sobre el grupo al que será incorporado. Es fácil que el investigador conozca qué tratamiento corresponde a cada uno de los grupos, como es el caso de intervenciones que asocian efectos adversos característicos. El interés personal del investigador en el éxito del nuevo tratamiento puede influir en que trate de evitar que los sujetos con mejor pronóstico o mayores expectativas de mejoría vayan al grupo control.
Enmascaramiento
Se definen como aquellos procedimientos realizados con el fin de que algunos de los sujetos relacionados con el estudio (equipo investigador, participantes, etc.) no conozcan algunos hechos u observaciones (básicamente el tratamiento que recibe cada sujeto) que pudieran ejercer un cambio en sus acciones o decisiones y sesgar los resultados. Un estudio que no utiliza técnicas de enmascaramiento se denomina ensayo abierto.
El cegamiento permite que cualquier grado de imparcialidad sobre alguna de las intervenciones en estudio por parte del investigador, o bien del sujeto participante (autosugestión, confianza en una nueva intervención, etc.), pueda influir sobre los resultados o la interpretación de estos. De este modo, se evita el denominado sesgo de realización, que se da cuando existen diferencias en el trato o la atención sanitaria que reciben los sujetos en función del grupo al que pertenezcan. Si el grupo asignado es desconocido, todos los sujetos recibirán exactamente la misma atención, excepto la propia intervención.
Se ha determinado que los ECA en los que no se especifica un adecuado ocultamiento pueden sobrestimar la medida del efecto en un rango del 30 al 40%, en relación con aquellos que sí explicitan métodos con esta finalidad.
Tipos de enmascaramiento
La técnica del simple ciego consiste en que los investigadores, o más frecuentemente los propios participantes, desconozcan qué intervención recibe cada individuo.
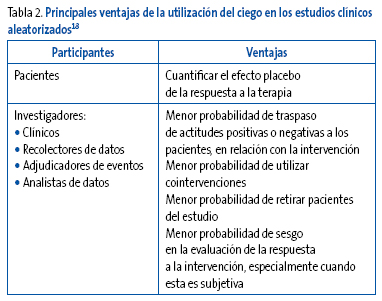
Si los investigadores conocen quién recibe cada intervención, o los participantes saben qué tratamiento reciben, existe la posibilidad de que se examine con mayor minuciosidad cualquier respuesta, o se pregunte con más detalle por los posibles efectos secundarios de alguno de los tratamientos. Estas preferencias se evitan con la técnica del doble ciego, donde tanto los pacientes como los investigadores desconocen el tratamiento administrado (Tabla 2).
Tabla 2. Mostrar/ocultar
La técnica del triple ciego, en la que, además, hay otras personas que también desconocen el tratamiento que recibe cada sujeto, ya sea el profesional estadístico que analizará los resultados, o la persona responsable de decidir si se suspende un tratamiento por la aparición de reacciones adversas o si debe interrumpirse prematuramente el ensayo.
Aunque lo más deseable para la realización de un ECA es seguir una metodología de doble ciego, esta no siempre es posible. En el caso de intervenciones farmacológicas, los efectos secundarios o el perfil de toxicidad de algunos fármacos impiden su cegamiento, así como en aquellos casos en los que no es posible disponer de una formulación galénica adecuada que actúe como grupo control placebo. Tampoco es posible cuando suponga riesgos innecesarios para el paciente, como en los casos en los que tendría que ser sometido a intervenciones quirúrgicas simuladas, o a administraciones repetidas de placebo por vía parenteral. Por último, en todos aquellos casos en los que por cualquier circunstancia el diseño doble ciego puede perjudicar la relación entre el médico y el paciente, no es conveniente llevarlo a cabo.
Cuando estos métodos no pueden llevarse a cabo, puede utilizarse la técnica de la evaluación enmascarada de la respuesta, o del evaluador ciego. Consiste en que la persona que ha de medir la variable de respuesta desconozca el grupo al que pertenece cada uno de los sujetos, con la finalidad de que la medición se realice e interprete de la misma forma para cada grupo.
Para establecer la validez del ciego en un ECA, más importante que la descripción acerca de si se trata de doble o triple ciego, es el detalle explícito de todos los que lo fueron en el desarrollo del ensayo, los métodos utilizados para lograrlo y su éxito o fracaso18.
Descripción de pérdidas y abandonos. Sesgo de seguimiento
Otro aspecto metodológico importante en la realización de un ECA es efectuar una correcta descripción de las pérdidas y abandonos durante su transcurso, es decir, recoger el número de sujetos que abandonan el estudio antes de su finalización, el grupo al que pertenecen y, si es posible, la causa del abandono o pérdida (aparición de evento adverso, falta de eficacia del tratamiento, etc.). Cada una de las causas tendrá un significado diferente en la valoración de la eficacia de la intervención en estudio y, por tanto, disponer de esta información es muy importante para que no se produzca el denominado sesgo de seguimiento.
A partir de esta información hay diferentes estrategias para analizar los datos y llegar a resultados válidos. Una de las opciones recomendadas es la realización de un análisis por intención de tratar. Según este, cada paciente es analizado en el grupo al que fue asignado al inicio del estudio, independientemente de que no terminara la intervención que correspondía a ese grupo. Este tipo de análisis, además de permitir controlar el sesgo de seguimiento, es la única estrategia que conserva las ventajas adquiridas mediante la asignación aleatoria de los sujetos, creando dos grupos comparables en todas las variables excepto en la intervención recibida, y es la estrategia que más se aproxima a la realidad de la práctica clínica diaria, donde los pacientes con frecuencia incumplen o rechazan los tratamientos prescritos.
Hay estudios que muestran resultados beneficiosos de una intervención al analizar solo los pacientes que completan o se adhieren al protocolo (análisis por protocolo o por tratamiento); sin embargo, al analizar por intención de tratar, los beneficios no son tan evidentes.
Los estudios realizados en niños precisan consideraciones especiales. Los investigadores deben medir los resultados obtenidos de la forma más rigurosa posible. Además, hay que considerar que los niños y los adultos responden de forma particular a los tratamientos realizados. Se debe contemplar la realización de grupos de edad para una mejor valoración de los ensayos clínicos en Pediatría19.
CRITERIOS DE CALIDAD DE UN ENSAYO CLÍNICO ALEATORIZADO
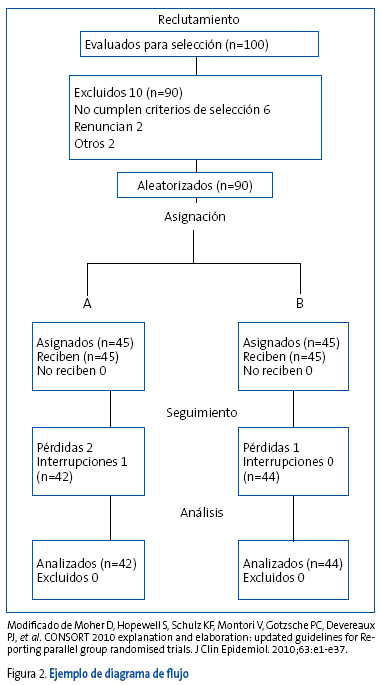
Para salvaguardar la garantía de la correcta elaboración de los estudios de investigación, y en un intento de mejorar la calidad de su publicación, han surgido guías de ayuda, entre las cuales hay al menos 25 escalas y nueve listas o checklists que tratan de evaluar la validez y la "calidad" de los EC. En el caso de estudios experimentales, la declaración CONSORT resulta recomendable para mejorar la calidad de la escritura y la publicación de los ensayos clínicos18. La declaración o guía CONSORT inicial permitió un aumento de la calidad de la comunicación de los ECA, y ha sido revisada en varias ocasiones20, la más reciente publicada en el año 201021. Incorpora en la actualidad una lista de comprobación o cuestionario de 25 ítems que se consideran críticos y que, por tanto, deberían incluirse en todo informe de un EC junto con el diagrama de flujo, en el que se establecen los cuatro apartados de un ECA: el reclutamiento, la intervención, el seguimiento y el análisis. En dicho diagrama debe constar la identificación sobre el seguimiento de los pacientes incluidos en el estudio, necesario para considerar la validez interna y la aplicabilidad de los resultados obtenidos, que muestra el flujo de individuos participantes a lo largo del estudio22.
Estas herramientas se centran en el ECA de dos grupos paralelos. Otros diseños, como los ensayos con aleatorización de conglomerados (en los que se aleatorizan grupos o "conglomerados" de individuos), los ensayos de no inferioridad o los ECA sobre tratamientos no farmacológicos pueden requerir información adicional y existen extensiones de CONSORT específicas para ellos que pueden consultarse en la página web del grupo CONSORT (http://www.consort-statement.org).
El grupo CONSORT integra una red internacional, la Red EQUATOR Network (Enhancing the Quality and Transparency of Health Research), que promueve y facilita la publicación de estudios de investigación de salud. En el sitio Web de la Red (www.equator-network.org), se aportan directrices sobre escritura científica o ética de la investigación23,24.
Se puede consultar un catálogo de las diferentes extensiones de la declaración CONSORT, así como más de 90 listas de comprobación desarrolladas para cada tipo de estudio25,26.
DECLARACIÓN CONSORT
La guía o declaración CONSORT 2010 incluye un listado de 25 recomendaciones que se consideran imprescindibles y que deberían incluirse en todo informe o publicación de un EC, junto con un diagrama (Figura 2) que muestre el flujo de individuos participantes a lo largo del ensayo.
Figura 2. Mostrar/ocultar
A continuación presentamos un resumen de los diferentes ítems que componen la guía CONSORT1,8,21.22:
Título y resumen
- En el título y en el resumen se identificará si se trata de un ECA.
- Resumen estructurado del diseño, métodos, resultados y conclusiones del ensayo (existe una versión específica de CONSORT for abstracts)27.
Introducción
La introducción incluirá tanto los antecedentes científicos como el motivo del estudio y los objetivos específicos o hipótesis.
Método
- Diseño: se describirá el diseño del ensayo clínico.
- Participantes: la población de individuos, se definirá por condición clínica de interés, se restringirá mediante criterios de selección. Se especificarán los criterios de inclusión, el ámbito y los centros en los cuales se realizó el ensayo, determinante para la validez externa o posibilidad de generalización de los resultados.
- Intervenciones: se incluirá el entrenamiento de quienes la practicaron. Se explicarán la generación de la secuencia de asignación y las restricciones impuestas.
- Objetivos: se destacará el principal de los secundarios. Se hará referencia a la potencia adecuada.
- Resultados: se definirán las medidas de los resultados principal y secundarios, así como de cualquier método utilizado para mejorar la calidad de las medidas.
- Tamaño muestral: se reseñará la forma en que se determinó la muestra.
-
Aleatorización:
- Se mencionará el método utilizado para generar la secuencia aleatoria.
- Tipo de aleatorización.
- Mecanismo utilizado para implementar la secuencia de asignación.
- Implementación: se comprobará si la asignación pudo ser predecible, implicará describir el método, quién preparó la secuencia de asignación, quién decidió la inclusión de los individuos y quién asignó el tratamiento.
- Enmascaramiento: para evitar que el prejuicio influya en el resultado del ensayo, deberán desconocerlo quienes lo repitieron, administraron o evaluaron los resultados.
- Métodos estadísticos: predeterminados durante el diseño, proporcionarán comparación y un intervalo de confianza para la estimación.
Resultados
- Flujo de participantes: se indicará el número de individuos evaluados al inicio para su inclusión, así como los no incluidos.
- Reclutamiento: se aportará la fecha de inicio y de finalización del reclutamiento.
- Datos basales: reflejarán las características demográficas y clínicas basales de los individuos.
- Números analizados: el número de casos incluidos en el análisis es un dato crítico para interpretar su resultado.
- Resultados y estimación: se describirán tanto el resultado principal como los secundarios para cada grupo de tratamiento.
- Análisis secundarios: aunque en un ECA se puede realizar más de un análisis diferencial, siendo importante informar sobre todos los análisis realizados.
- Acontecimientos adversos: se describirá la frecuencia de individuos que presentaron acontecimientos adversos y la de los que interrumpieron el tratamiento con los respectivos motivos.
Discusión
- Limitaciones: se señalarán las limitaciones del estudio. Se realizará una interpretación general de los resultados.
- Generalización: comprenderá la posibilidad de trasladar los resultados a conjuntos de individuos más amplios (validez externa) dependerá como requisito previo de la validez interna.
- Interpretación: a fin de evitar la propensión a justificar los estudios más que a poner de manifiesto sus limitaciones, se recomienda estructurar la discusión.
Otra información
- El registro: deberá aparecer el nombre y el número correspondiente del ECA.
- Protocolo: los detalles completos referentes al protocolo del ECA estarán disponibles.
- Las fuentes de financiación: se especificarán.
Para mayor información sobre cada uno de los 25 ítems que integran la guía CONSORT, la justificación de su importancia, y ejemplos de información adecuada extraídos de ECA publicados, se recomienda consultar el artículo de explicación y elaboración de la declaración CONSORT 201021,22.
BIBLIOGRAFÍA
- Argimón JM, Jiménez J. Estudios experimentales: el ensayo clínico aleatorio. En: Edide S.L. Métodos de Investigación Clínica y Epidemiológica, 3.ª ed. Madrid: Elsevier; 2004. p. 33-48.
- Cabrero Feliu L, de Abajo Iglesias FJ, de la Fuente Honrubia C, Serrano Castro MA. Rutas administrativas y requisitos éticos y legales en la investigación biomédica con seres humanos en España: una guía para investigadores. Med Clin (Bar). 2012; 139:118-25.
- Moher D, Villanueva E. Mejora de la calidad de las publicaciones sobre ensayos aleatorizados: colaboración entre autores, revisiones y editores. Med Clin (Barc). 2011;137(5):211-2.
- Andrés de Llano JM. Ensayos clínicos en atención primaria. Aten Primaria. 2006;38(7):375-80.
- Jiménez Villa J, Argimón Pallás JM. Análisis e interpretación de un ensayo clínico. FMC. 2009;16:261-71.
- Pérez-Maña C, Llonch C, Farré M. Transparencia en la investigación clínica: registro de los ensayos clínicos y publicación de resultados. Med Clin (Barc). 2012;139:593-7.
- Vianney Pons JM, Rodés J, Andreu A, Arenas J. La olvidada investigación clínica. Med Clin (Barc). 2013;140(7):325-31.
- Schulz KF, Altman DG, Moher D for the CONSORT Group. CONSORT 2010 Statement: updated guidelines for reporting pararell group randomised trials. Int J Surg. 2011;9:672-7.
- Rothman KJ. Epidemiología Moderna. Madrid: Editorial Díaz de Santos; 1987.
- Martín-Sánchez ER, Martín JL, Seoane T, Lurueña-Segovia S, Alonso Moreno FJ. El ensayo clínico. Metodología de calidad y bioética. Rev Formación Continuada Semergen. 2007;33(6):296-04.
- Campbell MK, Elbourne DR, Altman DG. Ensayos clínicos aleatorizados comunitarios (CONSORT CLUSTER). Med Clin (Barc). 2005;125 (Supl 1):28-31.
- Gálvez Múgica MA, de Pablo López Abechuco I. El proceso de evaluación de un ensayo clínico desde la perspectiva de un comité ético de investigación clínica. Rev Clin Esp. 2007;207(1):29-33.
- Gorrotxategui P. Aspectos éticos de la investigación biomédica. Form Act Pediatr Aten Prim. 2012;5(1):30-9.
- Avendaño Solá C, Delgadillos Duarte J, de Abajo FJ, Sanz N, en representación del Grupo de Trabajo de Ensayos Clínicos de la Sociedad Española de Farmacología Clínica.Cambios en la normativa europea de ensayos clínicos (II): por una regulación proporcionada y adaptada al riesgo. Med Clin (Barc). 2012;138(13):574-8.
- Ministerio de Sanidad y Consumo. Real Decreto 223/2004, de 6 de febrero, por el que se regulan los ensayos clínicos con medicamentos. BOE 2004; 33: 5429-5443 (BOE de 7 de febrero).
- Araya Alpízar C, Galindo Villardon MP. Tamaño de la muestra en investigación cllínica. Med Clin (Bac). 2009;133(1):26-30.
- Marrero Álvarez P, Ruiz Ramos J, Megías Vericat JE, Tordera Baviera M, Poveda Andrés JL. Evaluación de la hoja de información al paciente y del consentimiento informado en ensayos clínicos. Rev Calid Asist. 2012;(Epub ahead of print).
- Manríquez Moreno JJ, Silva Valenzuela S. Artículo especial ECA: definición y análisis crítico. Piel. 2006;21(6):275-80.
- Williams K, Thomson D, Seto I, Contopoulos-Ioannidis D, Ioannidis J, Curtis S, et al. Standard 6: Age groups for Pediatric trials. Pediatrics 2012;129;S153-S160.
- Altman DG, Schulz KF, Moner D, Egger M, Davidoff F, Elbourne D, et al. The revised CONSORT statement for Reporting randomized trials: explanation and elaboration. Ann Intern Med. 2001;134:663-94 21.
- Moher D, Hopewell S, Schulz KF, Montori V, Gotzsche PC, Devereaux PJ, et al. CONSORT 2010 explanation and elaboration: updated guidelines for Reporting parallel group randomised trials. J Clin Epidemiol. 2010;63:e1-e37.
- Cobos-Carbó A, Augustovski F. Declaración CONSORT 2010: actualización de la lista de comprobación para informar ensayos clínicos aleatorizados de grupos paralelos. Med Clin (Barc). 2011;137(5):213-5.
- Altman DG, Simera I, Hoey J, Moher D, Schulz K. EQUATOR: reporting guidelines for health research. Lancet. 2008;371:1149–50. Republished in Open Medicine. 2008;2:E24-5.
- González de Dios J, Buñuel Álvarez JC, González Rodríguez MP. Listas guía de comprobación de artículos científicos y la red EQUATOR. Evid Pediatr. 2011;7:47.
- Simera I, Moher D, Hoey J, Schultz K, Altman DG. A catalogue of reporting guidelines for health research. Eur J Clin Invest. 2010;40(1):35-53.
- Simera I, Moher D, Hirst A, Hoey J, Schultz K, Altman DG. Transparent and accurate reporting increases reliability, utility, and impact of your research: reporting guidelines and the EQUATOR Network. BMC Medicine 2010;8:24.
- Hopewell S, Clarke M, Moher D, Wager E, Middleton P, Altman DG, et al., and the CONSORT Group. CONSORT for reporting randomised trials in journal and conference abstracts. Lancet. 2008;371:281-3.
BIBLIOGRAFÍA RECOMENDADA
- Argimon JM, Jiménez J. Métodos de Investigación Clínica y Epidemiológica, 3ª ed. Madrid: Elsevier; 2004. p. 33-48.
- Rothman KJ. Epidemiología Moderna. Madrid: Editorial Díaz de Santos; 1987.
- Moher D, Hopewell S, Schulz KF, Montori V, Gotzsche PC, Devereaux PJ, et al. CONSORT 2010 explanation and elaboration: updated guidelines for Reporting parallel group randomised trials. J Clin Epidemiol. 2010;63:e1-e37.
- Schulz KF, Altman DG, Moher D for the CONSORT Group. CONSORT 2010 Statement: updated guidelines for reporting pararell group randomised trials. BMC Medicine. 2010,8:18.
- Simera I, Moher D, Hoey J, Schultz, Altman DG. A catalogue of reporting guidelines for health research. Eur J Clin Invest. 2010;40:35-53.