Inmunoterapia específica con alérgenos. Una visión desde el siglo XXI
2 Servicio de Alergia. IDIPAZ. Hospital Universitario La Paz. Madrid. Madrid (España).
RESUMEN
La inmunoterapia específica (ITE) con alérgeno constituye hoy el único tratamiento etiológico de los que dispone el médico en el tratamiento de la alergia respiratoria (rinitis, rinoconjuntivitis y/o asma alérgica) capaz de modificar el curso natural de la enfermedad. A pesar de que se ha utilizado durante más de 100 años, en las últimas décadas ha experimentado notables avances que han mejorado su eficacia y seguridad. Su indicación en la alergia respiratoria se sustenta en demostrar una relación causal clara entre la exposición alergénica y la clínica y, además, que la evitación del alérgeno no sea posible o completa.Se ha demostrado que reduce los síntomas, mejora la calidad de vida y es coste-eficiente. Previene la progresión de la rinitis al asma y el desarrollo de nuevas sensibilizaciones. Su perfil de seguridad es muy bueno, especialmente el de la IT sublingual. Esta revisión muestra los fundamentos de la ITE en la realidad del siglo XXI y que, dada la prevalencia de las enfermedades alérgicas hoy, creemos que es necesario conozca el pediatra de Atención Primaria.
INTRODUCCIÓN
La alergia respiratoria incluye la rinitis, asociada frecuentemente a conjuntivitis, y el asma alérgica. A pesar de que su sintomatología es diferente, estos dos trastornos afectan a la mucosa de las vías respiratorias y comparten procesos celulares comunes. La inhalación de alérgenos a los que el paciente está sensibilizado induce una respuesta inflamatoria mediada por anticuerpos IgE, que, en su fase más aguda tras una nueva exposición, conlleva la liberación de mediadores por parte de los mastocitos y otras células inflamatorias presentes en ese infiltrado, como los eosinófilos. De este modo, se produce la aparición de síntomas, al tiempo que se cronifica la presencia de inflamación que, en el bronquio, condiciona la hiperreactividad bronquial y la obstrucción al flujo aéreo inicialmente reversible1. Es destacable que la prevalencia de enfermedades alérgicas ha aumentado en la últimas tres décadas, tanto en niños, como en adultos2. Por ejemplo, según el estudio ISAAC, se estimaque la prevalencia de asma, en España, oscilaría entre el 7,1 y el 12,9% en niños de 6-7 años, y entre el 7 y el 15,3% en los de 13-143. Para adultos sería algo menor, estableciéndose alrededor de un 5%4.
La inmunoterapia específica (ITE) con alérgenos es la única estrategia terapéutica que trata la causa subyacente de la enfermedad alérgica mediante la inducción de un estado de tolerancia inmunológica5. Su indicación en la alergia respiratoria se sustenta en demostrar una relación causal clara entre la exposición alergénica y la clínica, y, además, en que la evitación del alérgeno no sea posible o completa. Consiste en la administración progresiva de cantidades crecientes de alérgeno al cual el paciente está sensibilizado con el fin de modular la respuesta inmune IgE-mediada al mismo, y con ello, la disminución de la intensidad de los síntomas. Se ha demostrado como tratamiento eficaz que reduce los síntomas, mejora la calidad de vida, disminuye el absentismo en el colegio y en el trabajo6, e incluso se ha comprobado su coste-eficacia7. Además del control de los síntomas, existe evidencia de que la ITE puede prevenir la progresión de la enfermedad de la rinitis al asma1 y el desarrollo de nuevas sensibilizaciones8.
La ITE, aunque está presente en la literatura médica desde hace más de 100 años9, ha cambiado mucho en la última década. Se ha profundizado en las técnicas de estandarización de extractos, lo que ha permitido la generación de extractos reproducibles lote a lote y consistentes en el tiempo; se han mejorado las pautas de inicio, acortándolas de manera significativa e, incluso, disponemos de nuevas vías de administración en forma de comprimidos sublinguales que han seguido un desarrollo clínico idéntico al de un fármaco. Por todo ello, presentamos esta revisión actualizada de los fundamentos de la ITE en la realidad del siglo XXI y que, dada la prevalencia de las enfermedades alérgicas hoy, es necesario conozca el pediatra de Atención Primaria.
INDICACIONES Y TIPOS DE INMUNOTERAPIA ESPECÍFICA
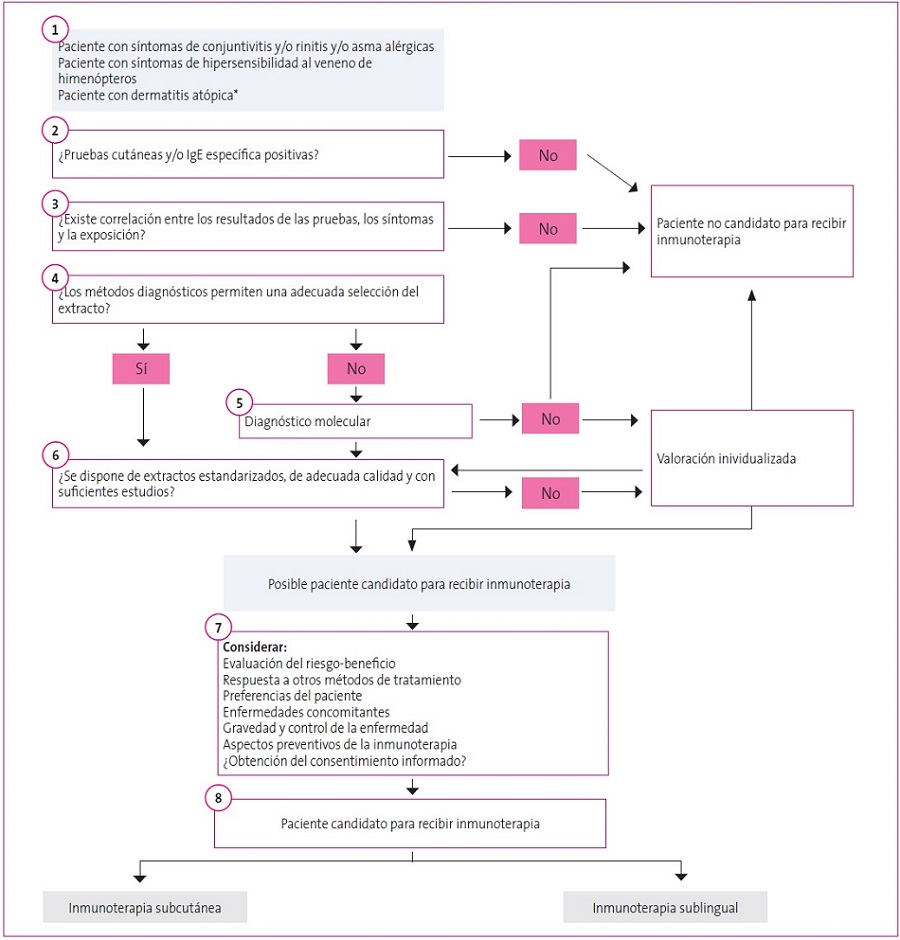
Puesto que es necesario comprobar la relación de la clínica con la exposición alergénica, la historia clínica alergológica es fundamental, y en algunos casos se recomienda un periodo de observación previo a la prescripción de la ITE. Esta historia clínica dirigida, junto con el estudio alergológico mediante pruebas cutáneas o cuantificación de IgE específica sérica y/o pruebas de exposición específica frente al alérgeno positivas, establece la relación causal y la indicación de ITE. Para una correcta elección de los alérgenos que se incluirán en el extracto elegido, es importante estar familiarizado con los aeroalérgenos más relevantes en la ubicación geográfica del paciente. La Figura 1 recoge el algoritmo de selección del paciente candidato a ITE propuesto por el Grupo Quasar (QUality in the Administration of SLIT in Allergic Rhinitis), un documento de consenso formado por 17 alergólogos españoles con experiencia en el manejo de la ITE10.
Figura 1. Algoritmo de selección del paciente candidato a ITE propuesto por el grupo Quashar. Mostrar/ocultar
Las principales indicaciones de la ITE se resumen en la Tabla 111. En general, en el tratamiento de la alergia respiratoria, se reserva para los casos en los que el paciente presenta rinitis/rinoconjuntivitis intermitente moderada-grave o rinitis persistente que precisa tratamiento sintomático mantenido y no acaba de alcanzar el control, asociada o no a asma alérgica de leve a moderada; no se puede conseguir la evitación completa del alérgeno; existen efectos secundarios con el uso de medicamentos; el paciente refiere importante afectación de su calidad de vida por la alergia respiratoria o, finalmente, es incapaz de cumplir el régimen de tratamiento12. Por el contrario, existen algunas contraindicaciones para utilizar ITE, especialmente vinculadas a la contraindicación para el uso de adrenalina y procesos en los que la inmunidad puede estar afectada como algunas enfermedades infecciosas y crónicas autoinmunes. Se recogen en la Tabla 2.
Tabla 1. Principales indicaciones de la inmunoterapia específica. Mostrar/ocultar
Tabla 2. Principales contraindicaciones para la inmunoterapia con alérgenos. Mostrar/ocultar
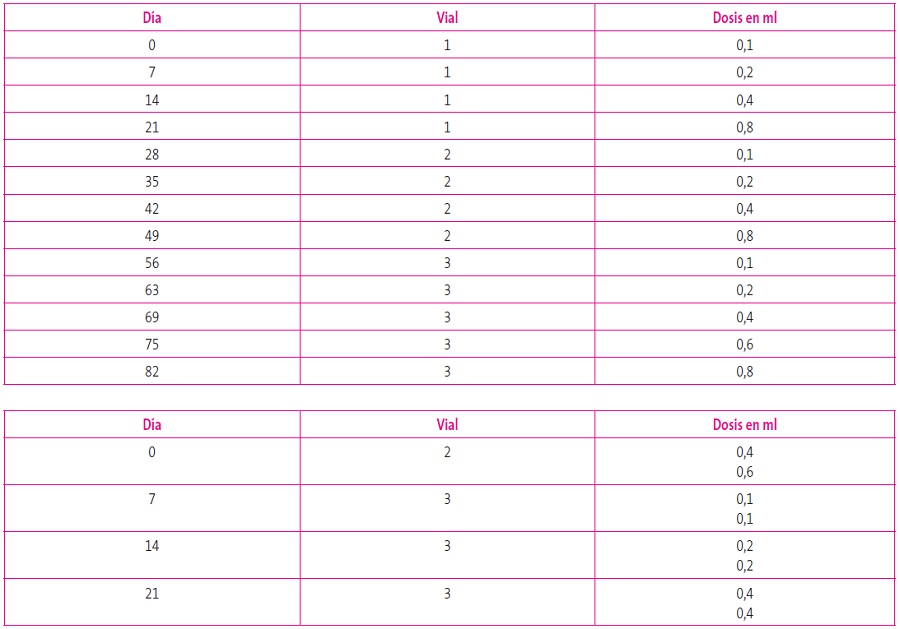
Existen dos tipos de ITE según la vía por la que se administra: puede ser subcutánea (ITSC) o sublingual (ITSL). Aunque existe suficiente evidencia sobre la efectividad de ambas al compararse respectivamente con placebo, existen pocos estudios que las comparen directamente y, en general, han sido estudios abiertos y con pocos pacientes13. Ambas vías presentan mecanismos de acción comunes, mediante cambios de la inmunidad celular, produciéndose una potenciación de la expresión de células T reguladoras, al tiempo que una reducción de linfocitos Th2 (característicos de la enfermedad alérgica mediada por la IgE), una disminución de su producción de interleucinas (IL-4, IL-5 e IL-13), así como un bloqueo de la respuesta ante la exposición alergénica, posiblemente a través del aumento de la IgG414. Sus indicaciones son similares pero, puesto que la ITSL presenta muy buen perfil de seguridad, se ha utilizado más frecuentemente en la población pediátrica, ya que, además, los niños suelen rechazar las inyecciones15. Dicho perfil de seguridad permite, además, administrar la ITSL en el domicilio del paciente y no en un centro médico. Con la ITSC, la pauta de inicio convencional se realiza con incrementos de dosis semanalmente, en un periodo amplio que suele superar los dos meses. Sin embargo, hoy se manejan pautas de inicio más rápido, agrupando dosis en un mismo día (pautas agrupadas o cluster), lo que reduce estos periodos de inicio a un intervalo de 1-4 semanas, para luego continuar con la pauta de continuación mensual, lo que ha acortado notablemente el periodo de inicio, sin aumento de las reacciones adversas y mejorando la comodidad del paciente16. Incluso con extractos depigmentados y polimerizados con glutaraldehido, se alcanza la dosis de mantenimiento mensual en un solo día. Por el contrario, implican acudir al centro hospitalario al deber estar siempre supervisadas por el médico especialista alergólogo. La Tabla 3 recoge un ejemplo de pauta agrupada frente a la de inicio convencional.
Tabla 3. Pautas de inicio convencional (arriba) y agrupada (debajo). Mostrar/ocultar
EFICACIA DE LA INMUNOTERAPIA
Aunque la eficacia global de la ITE en el tratamiento de las enfermedades alérgicas es apoyada por un extenso grupo de estudios, dada la heterogeneidad de los mismos, se tiende hoy a separarlos por alérgenos y vía de administración. Existen ciertas variables importantes que se deben tener en cuenta, como el uso de un único alérgeno o de múltiples, y si la dosis empleada está en el rango de lo que hoy se conoce como dosis efectivas. Por patologías, la ITE ha demostrado niveles distintos de eficacia:
- En pacientes con rinitis alérgica (RA),ambas vías de administración han demostrado su eficacia en comparación con el placebo en la reducción de los síntomas y en el consumo de medicación, tanto en niños como en adultos. Existen diferentes metaanálisis de estudios aleatorizados, doble-ciego controlados con placebo, que así lo indican. Uno realizado por Calderon et al. en 2007, en el que se incluyeron solo adultos en tratamiento con ITSC (n = 281), demostró una diferencia significativa en la eficacia en el control de síntomas y uso de medicación sintomática con respecto al placebo17. En 2010 se valoró el uso de ITSL en 60 estudios de estas características, incluyendo adultos y niños (n=4589), donde se demostró una reducción de los síntomas y de la medicación de forma significativa (p<0,00001)18. Ambas vías de administración previenen la progresión de RA a asma y el desarrollo de nuevas sensibilizaciones en sujetos sensibilizados a un único alérgeno1,5.
-
En el asma alérgica, el uso de la ITE es más controvertido, por el riesgo de presentar reacciones adversas, la falta de comprobación científica sobre su eficacia clínica o la escasez de estudios comparativos con fármacos. Existen múltiples estudios sobre la eficacia de la ITSC y la ITSL en pacientes con rinitis que asocian asma, pero hay pocos ensayos clínicos que evalúen la eficacia de la ITE en pacientes con asma sin rinitis. Por lo tanto, la prescripción de inmunoterapia con alérgenos en asma sigue siendo un tema de debate, ya que las guías oficiales no ofrecen recomendaciones claras a este respecto4. En los últimos años, se han publicado diferentes estudios que demuestran la eficacia de la inmunoterapia en pacientes asmáticos y alérgicos a pólenes de gramíneas, ácaros del polvo doméstico, látex, epitelios y hongos. Una revisión sistemática con ITSC, que incluye 88 ensayos clínicos, 70 de ellos doble ciego y controlados con placebo, y otra revisión que incluye 790 pacientes con síntomas de asma, concluyen con la evidencia de la eficacia del tratamiento en asma, especialmente con extractos de un solo alérgeno19.
Con ITSL en asma, existen dos metaanálisis que valoran su eficacia. El primero incluye pacientes de todas las edades (25 ensayos clínicos aleatorizados, doble ciego con 1706 pacientes) y demuestra un efecto beneficioso de la ITSL para el tratamiento del asma alérgica20. El segundo, limitado a enfermos pediátricos (9 estudios, 411 pacientes), muestra que la ITSL reduce la puntuación de síntomas y el uso de medicación de rescate en niños con asma alérgica21. Recientemente se han revisado 16 ensayos clínicos aleatorizados, doble ciego y controlados con placebo (794 pacientes), demostrando que la ITSL es segura y eficaz en la reducción de los síntomas y el uso de medicación para el asma alérgica, especialmente en los pacientes alérgicos a ácaros22. Finalmente, una revisión exhaustiva y reciente sobre la ITE en el asma muestra que pueden usarse ambas vías cuando el asma se presenta con rinitis y el alérgeno relevante es el responsable de la clínica, aunque no es recomendable en el asma no controlada, en el asma grave, ni cuando el asma es la única manifestación de alergia respiratoria (no asociada a rinitis)23.
- En alergia a alimentos, la ITSC se ha estudiado en la alergia al cacahuete, pero el perfil de reacciones sistémicas hizo abandonar esta vía24. Desde entonces, se han realizado estudios que demuestran la eficacia y tolerancia de la ITSL con extractos de avellana, cacahuete, polen de abedul en el síndrome manzana-abedul, melocotón, kiwi y con leche25.
- En dermatitis atópica se ha estudiado la eficacia de la ITSL con un extracto estandarizado de ácaros en niños con dermatitis atópica de leve a moderada, pero su beneficio fue variable en la forma grave26.
- En la alergia al látex, la ITSL ha obtenido un buen nivel de eficacia, con mejor tolerancia que cuando el extracto se administra por vía subcutánea, si bien el tamaño muestral es demasiado pequeño para obtener conclusiones definitivas27.
SEGURIDAD DE LA INMUNOTERAPIA
Las reacciones adversas inducidas por ITSC pueden ser locales o sistémicas. La gravedad de estas abarca desde síntomas leves a reacciones anafilácticas de grado 1 a potencialmente mortales o grado 4, según la categoría de gravedad aplicada por la Academia Europea de Alergia5. Sin embargo, a pesar de la extendida creencia de que las reacciones sistémicas con ITSC son frecuentes, en realidad son raras, y muchas veces evitables si se siguen protocolos definidos de actuación previa a su administración. En un estudio de tres años de duración, realizado entre 2007 y 2009, que incluyó aproximadamente ocho millones de dosis al año, la tasa de reacciones sistémicas con ITSC fue de un 0,1% aproximadamente, sin ninguna reacción mortal28. La mayoría de las reacciones sistémicas (86%) tuvieron lugar en los primeros 30 minutos tras la administración. Por ello, las guías recomiendan que los pacientes reciban la ITSC en un centro médico supervisado y permanezcan en observación durante los 30 minutos posteriores a la inyección5. Los principales factores de riesgo para desarrollar reacciones graves tras la administración de ITSC se detallan en la Tabla 412.
Tabla 4. Principales factores de riesgo de reacción sistémica con ITSC. Mostrar/ocultar
La ITSL demuestra una buena tolerancia tanto en niños como en adultos, siendo las reacciones locales como el prurito o el edema de labios los efectos adversos más frecuentes, hasta en más del 40% de los pacientes29. Estos síntomas se desarrollan rápidamente después de la toma y duran pocos minutos. Además, se estabilizan tras una o dos semanas de tratamiento continuado. Otras reacciones adversas descritas incluyen náuseas, dolor abdominal, rinitis, conjuntivitis y tos. Por ello, son pocas las ocasiones en las que se debe interrumpir el tratamiento. En muy raras ocasiones se han descrito reacciones sistémicas como urticaria, angioedema y asma. No se han publicado muertes por su administración, aunque sí algunos pocos casos de reacciones anafilácticas, cinco de ellas en pacientes asmáticos30. No se han identificado factores predictivos pero sí se dan más frecuentemente en pacientes con alergias graves en temporada de polen y con antecedentes de reacciones sistémicas previas, incluyendo las secundarias a ITSC12.
CONCLUSIONES
La ITE se ha convertido en un tratamiento eficaz para la alergia respiratoria, la alergia a venenos de himenópteros y en algunos pacientes con alergia a alimentos. La aplicación del método científico a esta terapia ha permitido señalar sus fortalezas y también algunas carencias que han derivado en el diseño de nuevos estudios, analizando así rigurosamente variables de eficacia y seguridad. Además de la mejora de la clínica, puede jugar un papel relevante en prevenir la progresión de la enfermedad alérgica respiratoria, evitando el desarrollo de asma en pacientes con rinitis y el desarrollo de nuevas sensibilizaciones, lo que es particularmente en interesante en la población pediátrica.
A diferencia del tratamiento sintomático, la ITE trata la causa de la enfermedad, lo cual hace que ambas formas de tratamiento no sean excluyentes entre sí, y se complementen junto a las medidas de evitación alergénica. Hoy en día, el diagnóstico especializado del paciente alérgico es más preciso y, además, contamos con extractos bien estandarizados, en pautas de inicio corto, administrados por vía subcutánea y sublingual, lo que facilita una prescripción del tratamiento más individualizada y, posiblemente, de mayor calidad. Si añadimos que ambas vías son muy seguras, particularmente la ITSL, podemos afirmar que la ITE se ha convertido en una herramienta terapéutica muy útil para muchos pacientes con alergia respiratoria.

BIBLIOGRAFÍA
- Morjaria JB, Caruso M, Rosalia E, Russo C, Polosa R. Preventing progression of allergic rhinitis to asthma. Curr Allergy Asthma Rep. 2014;14:412.
- Izquierdo-Domínguez A, Valero AL, Mullol J. Comparative analysis of allergic rhinitis in children and adults. Curr Allergy Asthma Rep. 2013;13:142-51.
- Navarro A, Colas C, Anton E, Conde J, Dávila I, Dordal MT, et al. Rhinoconjunctivitis Committee of the SEAIC. Epidemiology of allergic rhinitis in allergy consultations in Spain: Alergológica-2005. J Investig Allergol Clin Immunol. 2009;19 Suppl. 2:7-13.
- Executive Comittee GEMA 2009. GEMA 2009. Guía española para el manejo del asma. J Investig Allergol Clin Immunol. 2010; 20(Suppl 1):1-59.
- Burks AW, Calderon MA, Casale T, Cox L, Demoly P, Jutel M, et al. Update on allergy immunotherapy: American Academy of Allergy, Asthma & Immunology/ European Academy of Allergy and Clinical Immunology PRACTALL consensus Report. J Allergy Clin Immunol. 2013;131:1288-96.
- Eifan AO, Shamji MH, Durham SR. Long-term clinical and immunological effects of allergen immunotherapy. Curr Opin Allergy Clin Immunol. 2011;11:586-93.
- Cox L, Calderon M, Pfaar O. Subcutaneous allergen immunotherapy for allergic disease: examining efficacy, safety and cost-effectiveness of current and novel formulations. Immunotherapy. 2012;4:601-16.
- Fiocchi A, Fox AT. Preventing progression of allergic rhinitis: the role of specific immunotherapy. Arch Dis Child Educ Pract Ed. 2011;96:91-100.
- Noon L. Prophylactic inoculation against hay fever. Lancet. 1911;177:1572-3.
- Davila I, Navarro A, Dominguez-Ortega J, Alonso A, Antolin-Amerigo D, Dieguez C, et al.; Grupo QUASAR (QUality in the Administration of SLIT in Allergic Rhinitis). SLIT: indications, follow-up, and management. J Investig Allergol Clin Immunol. 2014;24(Suppl 1):in press.
- Georgy MS, Saltoun CA. Allergen immunotherapy: Definition, indication, and reactions. Allergy Asthma Proc. 2012;33:S9-S11.
- Cappella A, Durham SR. Allergen immunotherapy for allergic respiratory diseases. Hum Vaccin Immunother. 2012;8:1499-512.
- Dretzke J, Meadows A, Novielli N, Huissoon A, Fry-Smith A, Meads A.Subcutaneous and sublingual immunotherapy for seasonal allergic rhinitis: A systematic review and indirect comparison. J Allergy Clin Immunol. 2013;131:1361-6.
- Moingeon P. Update on immune mechanisms associated with sublingual immunotherapy: practical implications for the clinician. J Allergy Clin Immunol: In Practice. 2013;1:228-41.
- Canonica GW, Bousquet J, Casale T, Lockey RF, Baena-Cagnani CE, Pawankar R, et al. Sublingual immunotherapy: world allergy organization position paper 2009. World Allergy Organ J. 2009;2:233-81.
- Tabar I, Echechipia S, Garcia BE, Olaguibel JM, Lizaso MT, Gomez B, et al. Double-blind comparative study of cluster and conventional immunotherapy schedules with Dermatophagoides pteronyssinus. J Allergy Clin Immunol. 2005;116:109-18.
- Calderon MA, Alves B, Jacobson M, Hurwitz B, Sheikh A, Durham S. Allergen injection immunotherapy for seasonal allergic rhinitis. Cochrane Database Syst Rev. 2007:CD001936.
- Radulovic S, Calderon MA, Wilson D, Durham S. Sublingual immunotherapy for allergic rhinitis. Cochrane Database Syst Rev. 2010:CD002893.
- Erekosima N, Suárez-Cuervo C, Ramamathan M, Kim JM, Chedarullai Y, Segal JB, et al. Effectiveness of subcutaneous immunotherapy for allergic rhinoconjunctivitis and asthma: a systematic review. Laryngoscopie. 2014;124:616-27.
- Calamita Z, Saconato H, Bronhara Pela A, Atallah AN. Efficacy of sublingual immunotherapy in asthma: Systematic review of randomized clinical trials. Allergy. 2006;61:1162-72.
- Penagos M, Passalacqua G, Compalati E, Tarantini F, Canonica GW. Meta-analysis of the efficacy of sublingual immunotherapy in the treatment of allergic asthma in pediatric patients, 3 to 18 years of age. Chest. 2008;133:599-609.
- Tao L, Shi B, Shi G, Wan H. Efficacy of sublingual immunotherapy for allergic asthma: retrospective meta-analysis of randomized, double-blind and placebo-controlled trials. Clin Respir J.2014;8:192-205.
- Passalacqua G. Specific immunotherapy in asthma: a comprehensive review. J Asthma. 2014;51:29-33.
- Nelson HS, Lahr J, Rule R, Bock A, Leung D. Treatment of anaphylactic sensitivity to peanuts by immunotherapy with injections of aqueous peanut extract. J Allergy Clin Immunol. 1997;99:744-51.
- Tang ML, Martino DJ. Oral immunotherapy and tolerance induction in childhood. Pediatr Allergy Immunol. 2013;24:512-20.
- Pajno GB, Caminiti L, Vita D, Barberio G, Salzano G, Lombardo F, et al. Sublingual immunotherapy in mite-sensitized children with atopic dermatitis: a randomized, double-blind, placebo-controlled study. J Allergy Clin Immunol. 2007;120:164-70.
- Patriarca G, Nucera E, Buonomo A, Roncallo C, De Pasqualle T, Pollastrini E, et al. New insights on latex allergy diagnosis and treatment. J Investig Allergol Clin Immunol. 2002;12:169-76.
- Epstein TG, Liss GM, Murphy-Berendts K, Bernstein DI. Immediate and delayed-onset systemic reaction after subcutaneous immunotherapy injections: ACAAI/AAAAI surveillance study of subcutaneous immunotherapy: year 2. Ann Allergy Asthma Immunol. 2011;107:426-31.e1.
- Calderon MA, Cox LS. Monoallergen sublingual immunotherapy versus multiallergen subcutaneous immunotherapy for allergic respiratory diseases: a debate during the AAAAI. 2013 Annual Meeting in San Antonio, Texas. J Allergy Clin Immunol Pract. 2014;2:136-43.
- Calderon MA, Simons FE, Malling HJ, Lockey RF, Moingeon P, Demoly P. Sublingual allergen immunotherapy: mode of action and its relationship with the safety profile. Allergy, 2012;67:302-11.
LECTURAS RECOMENDADAS
-
Burks AW, Calderon MA, Casale T, Cox L, Demoly P, Jutel M, et al. Update on allergy immunotherapy: American Academy of Allergy, Asthma & Immunology/European Academy of Allergy and Clinical Immunology PRACTALL consensus Report. J Allergy Clin Immunol. 2013;131:1288-96.
Se trata del consenso en inmunoterapia al que se ha llegado por expertos de las Academias Europea y Americana de Alergología con respecto a la ITE. Se aborda su eficacia, su modo de administración y la seguridad demostrada en la literatura médica.
-
Página web de la Sociedad Española de Alergia e Inmunología Clínica. www.seaic.org
En la parte dedicada a pacientes, se enlaza con el Libro de las enfermedades alérgicas de la fundación BBVA.Aunque aparentemente para pacientes, el capítulo 52, referido a la inmunoterapia, está ampliamente desarrollado por dos de los mejores expertos españoles en este campo.