Dolor lumbar como síntoma guía en dermatomiositis juvenil (DMJ)
2 Pediatra. CS Delicias. Málaga (España).
3 FEA de Pediatría. Hospital Materno Infantil. Málaga (España).
PUNTOS CLAVE
- El dolor lumbar puede ser motivo de consulta en Pediatría; solo en determinadas ocasiones será necesario realizar estudios complementarios.
- Ante la existencia de debilidad muscular debe realizarse una adecuada exploración neurológica y del sistema musculoesquelético, que incluya la realizacióno de escalas que valoren la debilidad muscular de forma objetiva.
- El daño muscular es la segunda causa de hipertransaminasemia, después del origen hepático.
- La presencia de manifestaciones cutáneas en el contexto de una miopatía deben orientar el diagnóstico hacia una miopatía inflamatoria.
- Aunque no se encuentra incluida dentro de los criterios diagnósticos clásicos de DMJ vigentes, la resonancia magnética (RM) muscular podría evitar la realización de biopsia muscular o bien orientar el lugar más adecuado para su realización.
- El pediatra de Atención Primaria debe conocer las complicaciones más frecuentes asociadas a esta enfermedad y a su tratamiento, así como las peculiaridades en aspectos básicos como la vacunación.
RESUMEN
En un paciente con debilidad muscular asociada a manifestaciones cutáneas debe plantearse como una de las primeras posibilidades diagnósticas la dermatomisitis juvenil (DMJ). La elevación de la creatinofosfocinasa (CPK) y las transaminasas, así como la electromiografía ayudarán a orientar el diagnóstico en este sentido, aunque clásicamente se consideraba necesario realizar la biopsia muscular, actualmente las pruebas de imagen pueden evitar la realización de pruebas invasivas para alcanzar el diagnóstico definitivo. El manejo de esta enfermedad requiere tratamiento corticoideo sistémico, seguido de tratamiento inmunosupresor de mantenimiento durante un tiempo prolongado. El seguimiento será llevado a cabo por Reumatología Pediátrica, siendo fundamental que el pediatra de Atención Primaria conozca las posibles complicaciones derivadas de la enfermedad o de su tratamiento, así como el manejo de situaciones frecuentes con peculiaridades concretas en estos niños, tales como las infecciones o la vacunación.
CASO CLÍNICO
Niño de cinco años que acude al Servicio de Urgencias de un hospital de tercer nivel por presentar desde hace cuatro semanas una tumoración en la región pretibial derecha de aproximadamente 2 cm, de consistencia dura y no dolorosa, que su pediatra había considerado como un posible hematoma calcificado. También refiere desde hace tres semanas dolor en ambos miembros inferiores y desde hace 48 horas dolor lumbar que dificulta la sedestación y la marcha. No presenta fiebre ni otra sintomatología ni ningún antecedente personal ni familiar de interés.
En la exploración presenta un buen estado general, con auscultación y exploración abdominal normales. Destaca una marcha basculante, con rectificación de la columna lumbar y dolor a la palpación a nivel de las apófisis espinosas L1-L2. La exploración neurológica, aunque difícil de realizar por la escasa colaboración del niño, evidencia una hipotonía axial con limitación para realizar la flexión del tronco e incapacidad para alcanzar la sedestación desde decúbito. La tumoración referida en la cara anterior de la pierna derecha es de consistencia pétrea, de unos 2 cm de diámetro, sin signos inflamatorios externos y levemente dolorosa a la palpación.
Se realiza en Urgencias hemograma, bioquímica básica, ionograma, reactantes de fase aguda, radiografía de columna dorsolumbar y ecografía abdominal con resultados normales, así como una ecografía lumbar que revela la existencia de infiltración grasa de la musculatura paravertebral distal bilateral, sugerente de atrofia, sin otras alteraciones. Ante la posibilidad de que pueda tratarse de una espondilodiscitis se ingresa al paciente en la planta de hospitalización para comenzar la administración de antibioterapia intravenosa empírica y ampliar el estudio.
Durante su ingreso se repite la analítica sanguínea, que se mantiene sin cambios, y se amplían los estudios analíticos con velocidad de sedimentación globular (VSG), serología infecciosa, Mantoux y coprocultivo, todo ello con resultado normal. Las RM de cráneo y neuroeje no muestran alteraciones y la ecografía de la tumoración del miembro inferior derecho evidencia una tumoración calcificada externa a la aponeurosis muscular de características inespecíficas. Al cuarto día de ingreso, el niño desarrolla un edema palpebral bilateral, que progresivamente va adquiriendo una leve tonalidad eritematosa. El estudio de orina y la radiografía de tórax realizados son normales. En este momento se solicita una nueva analítica sanguínea que incluye función hepática, detectando hipertransaminasemia (transaminasa glutámico pirúvica [GPT] 247 U/l y transaminasa glutámico oxalacética [GOT] 331 U/l) con elevación de la lactatodeshidrogenasa (LDH) (774 U/l) y CPK (5560 U/l; normal < 308 U/l), sin otros hallazgos analíticos de interés. La electromiografía muestra un patrón miopático.
La puntuación en la escala Childhood Myositis Assessment Scale (CMAS (Tabla 1) fue de 15 puntos sobre 52. Ante la sospecha de una enfermedad miopática inflamatoria se realiza estudio de extensión de la afectación muscular (tránsito gastroesofágico y ecocardiografía), estudio de autoinmunidad y capilaroscopia, no mostrando alteraciones. Una nueva RM muscular de miembros inferiores evidencia importante edema muscular de la musculatura pélvica, muslos y tercio superior de ambas piernas. Finalmente se completa el estudio con una biopsia muscular.
Tabla 1. Ítems evaluados en la escala Childhood Myositis Assessment Scale (CMAS)1. Mostrar/ocultar
El tratamiento antibiótico intravenoso (cefotaxima y cloxacilina) instaurado al ingreso por la sospecha de una espondilodistitis se suspende tras recibir los resultados de la RM y se inician bolos de metilprednisolona intravenosa durante tres días. Dada la grave afectación muscular y la presencia de calcinosis, se decide asociar gammaglobulina intravenosa. Previo al alta se inició tratamiento de mantenimiento con prednisona oral y metotrexato.
La normalización analítica (GPT 80 U/l, GOT 24 U/l, LDH 264 U/l y CPK 100 U/l) y la mejoría de la debilidad muscular se produjeron tras cinco semanas de tratamiento.
El resultado de la biopsia muscular evidenció edema, atrofia y regeneración muscular perifascicular e infiltrado perivascular de linfocitos CD3 positivos con marcada sobreexpresión membranosa y citoplásmica de MHC-I, datos compatibles con dermatomiositis juvenil.
El resultado de la biopsia muscular recibido después de que nuestro paciente empezara a mejorar clínicamente confirma el diagnóstico de dermatomiositis juvenil.
DISCUSIÓN
Diagnóstico diferencial de dolor lumbar
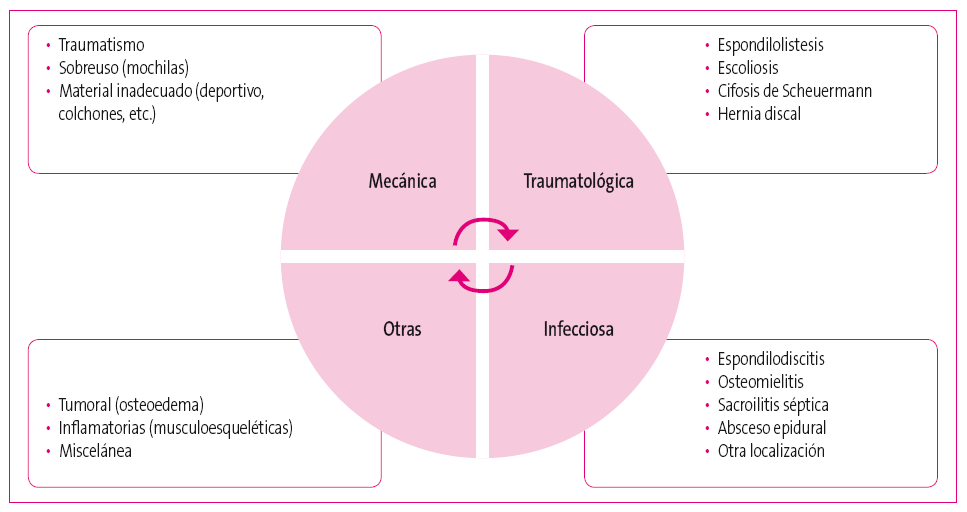
El dolor lumbar es un síntoma relativamente frecuente de consulta en Pediatría (Figura 1). No está indicado realizar estudios complementarios salvo que exista algún signo o síntoma de alarma2 (Tabla 2).
Figura 1. Diagnóstico diferencial del dolor lumbar. Mostrar/ocultar
Tabla 2. Signos o síntomas de alarma ante dolor lumbar2. Mostrar/ocultar
La existencia de dolor nocturno y las alteraciones en la marcha (atribuidas al dolor) fueron los motivos de la realización de pruebas complementarias en este paciente. La normalidad de los estudios realizados (a excepción de la atrofia de la musculatura paravertebral, también atribuida a desuso por dolor) no permitió descartar totalmente la causa infecciosa, motivo por el que se decidió iniciar antibioterapia empírica.
La nula respuesta a esta, unida a la aparición de un edema palpebral bilateral, hizo sospechar un posible síndrome de compresión de vena cava superior, que quedó descartado con la normalidad de la radiografía de tórax. A pesar de ello, este hallazgo motivó la ampliación del estudio bioquímico en el que se detectó la aparición de hipertransaminasemia, con elevación de LDH y CPK.
Diagnóstico diferencial de hipertransaminasemia
A pesar de ser múltiples las causas de hipertransaminasemia, en un paciente con sintomatología musculoesquelética este hallazgo orienta hacia la presencia de una miopatía, reafirmado por la alteración de los niveles plasmáticos de CPK3,4. La elevación de esta y la existencia de patrón miopático en la electromiografía (EMG) permitieron el diagnóstico de miopatía. En la Tabla 3 se exponen las miopatías más frecuentes, cada una de las cuales presentan características diferenciales. En nuestro caso, la sospecha diagnóstica se orientó hacia una miopatía inflamatoria, concretamente la dermatomiositis juvenil, apoyado este hecho por la existencia de eritema en heliotropo, calcinosis y edema muscular en RM.
Tabla 3. Clasificación de las miopatías3. Mostrar/ocultar
Evaluación de la fuerza muscular
Aunque existen diferentes escalas pediátricas para evaluar la fuerza muscular, la más utilizada es la escala Childhood Myositis Assessment Scale (CMAS) (Tabla 1).
Esta escala1 tiene 14 ítems, puntuados de 0 a 3, siendo la máxima puntuación posible 52 puntos. Evalúa de forma conjunta grupos musculares en la realización de actividades (no de forma aislada), siendo sencilla de emplear en niños pequeños. Aunque no está establecido un punto de corte a partir del cual considerar que existe debilidad muscular, se ha visto que en niños sanos mayores de cuatro años la puntuación media que obtienen es de 46,6 puntos. Puntuaciones inferiores a 15 puntos se consideran debilidad muscular grave.
DERMATOMIOSITIS JUVENIL
Epidemiología
La dermatomiositis juvenil es la miopatía inflamatoria idiopática más frecuente en la edad pediátrica, con una incidencia de 0,8-4,1/1 000 000 niños/año. Afecta predominantemente a niñas (relación 1:2-5), con una edad media de inicio de los síntomas en torno a los siete años.
Etiología
Su causa es desconocida, aunque se postula que existen factores ambientales, tales como infecciones o exposición a luz ultravioleta, que, al actuar sobre un individuo genéticamente predispuesto, HLA B*08, DRB1*0301, DQA1*0501, y diferentes haplotipos de genes que codifican citocinas proinflamatorias, como el factor de necrosis tumoral alfa (TNF-α) o interleucinas (IL-1α e IL-1β) desencadenarían la aparición de la enfermedad.
Se han descrito polimorfismos genéticos que actuarían como factores protectores frente al desarrollo de la enfermedad (HLA DQA1*0201, *0101, *0102 y TNF-α 238AG).
Patogenia
El sustrato fundamental sobre el que asienta la clínica de esta enfermedad es la afectación vascular, ya sea como fenómeno vasculítico o bien como vasculopatía, que acaba provocando isquemia de los diferentes tejidos implicados, fundamentalmente el músculo estriado y la piel.
De forma somera, se cree que algún autoantígeno aún no conocido pondría en marcha la cascada del complemento a nivel vascular, iniciando así el proceso inflamatorio primario en el vaso. La formación del complejo de ataque a la membrana induciría la formación de citocinas proinflamatorias que estimularía la migración de linfocitos T CD4+ y linfocitos B a la pared del vaso, perpetuándose el proceso.
Clínica
Las manifestaciones clínicas de la enfermedad se resumen en la Tabla 4.
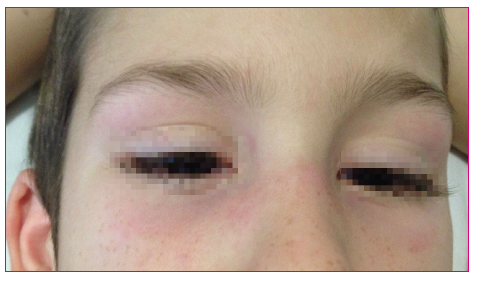
La existencia de manifestaciones cutáneas es obligatoria para establecer el diagnóstico de la enfermedad, pudiendo preceder a la clínica muscular o aparecer de forma simultánea a ella. No hay ninguna manifestación cutánea específica de dermatomiositis; las más características de la enfermedad son las pápulas de Gottron y el eritema en heliotropo (Figura 2).
Tabla 4. Manifestaciones clínicas de la dematomiositis juvenil. Mostrar/ocultar
Figura 2. Eritema en heliotropo. Mostrar/ocultar
Otras manifestaciones clínicas más inespecíficas son la fiebre y la astenia, como en otras enfermedades reumatológicas. Es posible encontrar síntomas o signos propios de inflamación de cualquier otra localización pues, a pesar de la predilección por el sistema muscular y la piel, se trata de una enfermedad de naturaleza multisistémica.
Diagnóstico
Actualmente siguen vigentes los criterios de Bohan y Peter de 1975 (Tabla 5). El diagnóstico de DMJ es seguro si se cumplen cuatro de los cinco criterios, siendo obligatoria la existencia de algún tipo de alteración cutánea característica de dermatomiositis5.
Tabla 5. Criterios diagnósticos de DMJ6. Mostrar/ocultar
Estos criterios incluyen la realización de pruebas invasivas para poder diagnosticar la enfermedad, como son la EMG y la biopsia muscular. Gracias a los avances que se han producido en las pruebas de imagen, es posible que pronto la RM muscular se incluya como criterio diagnóstico en detrimento de la biopsia muscular. De esta forma, la presencia de edema muscular en secuencias T2 y secuencias STIR (que permiten distinguir entre grasa y líquido/edema en las imágenes del RM) en un paciente que cumpla el resto de criterios quizás pueda permitir en el futuro diagnosticar la enfermedad sin necesidad de realizar la biopsia muscular, aunque algunos grupos abogan por realizar biopsia en todos los casos, dadas las posibles complicaciones pronósticas y terapéuticas del diagnóstico histológico.
Dado que, en la DMJ la afectación muscular es parcheada, la realización de la RM también ayuda a localizar las zonas más adecuadas para realizar la biopsia muscular.
En cualquier caso, si la clínica no es totalmente compatible o existe algún tipo de duda diagnóstica, debe realizarse la biopsia muscular.
Tratamiento
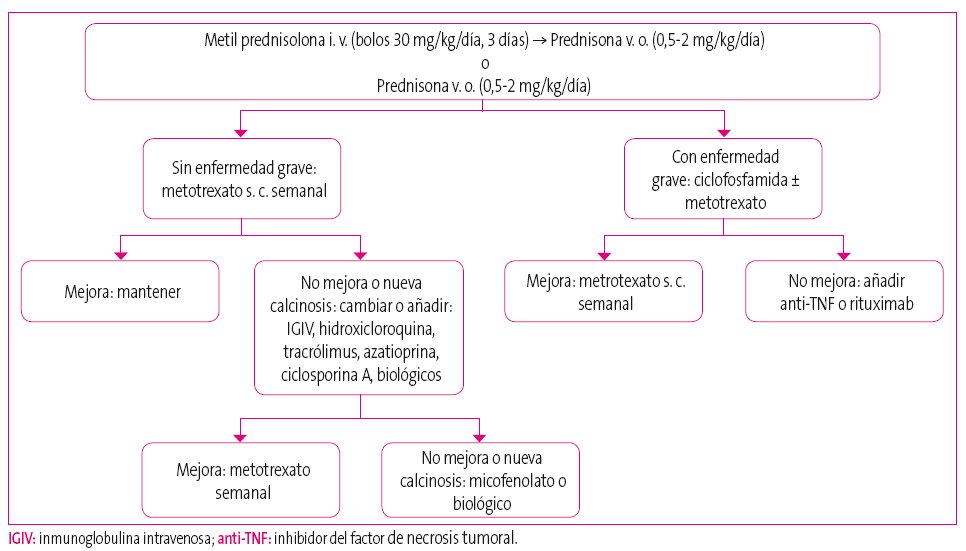
El tratamiento de la DMJ (tanto el brote agudo como en la fase de mantenimiento de la enfermedad) corresponde a pediatras de Unidades Especializadas. Se presenta brevemente en el esquema (Figura 3) un algoritmo de tratamiento realizado a partir de un consenso de expertos6,7.
Figura 3. Algoritmo de tratamiento DMJ realizado en base a las recomendaciones de un consenso de expertos6,7. Mostrar/ocultar
Seguimiento en Atención Primaria
Destacar, sin embargo, que estamos ante enfermedades que precisan tratamiento de mantenimiento durante periodos muy largos, por lo que el pediatra de Atención Primaria debe conocer los efectos secundarios más frecuentes y las peculiaridades que el tratamiento inmunosupresor supone en los programas habituales de manejo del niño sano, incluyendo las infecciones y la vacunación.
Tal y como se hemos expuesto anteriormente (Figura 3), los tratamientos indicados en el tratamiento de la DMJ varían en función de la gravedad del caso. Uno de los fármacos más utilizados es el metotrexato, antagonista del ácido fólico que inhibe la proliferación celular, con efecto antiinflamatorio e inmunosupresor. Los efectos secundarios más frecuentes asociados a su empleo son las náuseas y los vómitos, que pueden aliviarse suplementando con ácido fólico. Menos frecuentemente, pero con una prevalencia no desdeñable, el metotrexato puede producir una elevación de transaminasas, que suele normalizarse al disminuir la dosis, aunque con niveles superiores a tres veces el nivel normal puede estar indicada su suspensión. Las alteraciones hematológicas y de la función renal son efectos secundarios poco frecuentes8.
Los fármacos antirreumáticos modificadores de enfermedad (FAME) se han asociado a una susceptibilidad aumentada de padecer infecciones, fundamentalmente infecciones virales leves. El mayor riesgo se produce con el empleo de FAME biológicos, como los anti-TNFα, siendo la infección respiratoria de vías bajas la infección más frecuente en estos pacientes, y el S. pneumoniae el agente etiológico más frecuente en la neumonía bacteriana. Por ello, se recomienda la vacunación antineumocócica antes de comenzar el tratamiento y la vacunación antigripal anual, así como también la inmunización frente a la varicela.
Si durante el tratamiento con FAME (no biológico o biológico) se produce un proceso febril, se recomienda no administrar dicho tratamiento hasta la resolución total del proceso intercurrente.
Respecto a la vacunación en niños con tratamiento inmunosupresor, la actitud es variable según el tipo de fármaco empleado. Así, los FAME sintéticos como el metotrexato o la ciclosporina parecen no modificar el efecto de la vacunación con vacunas inactivadas. Las vacunas vivas son seguras en caso de tratarse de la segunda dosis o booster y cuando la dosis es de 10 mg/m2. No se recomienda con dosis mayores o en primovacunación. Tampoco se recomiendan las vacunas vivas en niños tratados con FAME biológicos como el rituximab. Las vacunas inactivadas son seguras en estos niños, aunque no está claro si su efecto pudiera estar disminuido por el efecto que los fármacos tienen sobre la inmunidad celular9,10.
BIBLIOGRAFÍA
- Valls Solé J, Santamaría Cano J, Rovira Cañellas A. Pruebas complementarias en neurología. En: Rozmán C, Farreras Valentí P. Medicina Interna. Vol. II. 16.ª edición. Barcelona: Elsevier; 2010. p. 1392-1403.
- Huber AM, Feldman BM, Rennebohm RM, Hicks JE, Lindsley CB, Perez MD, et al. Validation and clinical significance of the Childhood Myositis Assessment Scale for assessment of muscle function in the juvenile idiopathic inflammatory myopathies. Arthritis Rheum. 2004;50:1595-603.
- López Pisón J. HiperCKemia en Pediatría. Form Act Pediatr Aten Prim. 2013;6:133-8.
- Navas López VM, Blasco Alonso J, Sierra Salinas C. Hepatopatías infantiles. Fallo hepático. En: Jurado A, Urda AL, Núñez E. Guía esencial de diagnóstico y terapéutica en Pediatría. Madrid: Panamericana; 2011. P. 745-57.
- Modesto C. Protocolo de diagnóstico y tratamiento de la dermatomiositis juvenil (DMJ). Proto Diagn Ter Pediatr. 2014;1:91-100.
- Huber AM, Giannini EH, Bowyer SL, Kim S, Lang B, Lindsley CB, et al. Protocols for the initial treatment of moderately severe juvenile dermatomyositis: results of a Children's Arthritis and Rheumatology Research Alliance Consensus Conference. Arthritis Care Res (Hoboken). 2010;62:219-25.
- Huber AM, Robinson AB, Reed AM, Abramson L, Bout-Tabaku S, Carrasco R, et al. Consensus treatments for moderate juvenile dermatomyositis: beyond the first two months. Results of the second Childhood Arthritis and Rheumatology Research Alliance consensus conference. Arthritis Care Res (Hoboken). 2012;64:546-53.
- Comité de Medicamentos de la Asociación Española de Pediatría. Metotrexato. En: Pediamécum [en línea] [consultado el 15/06/2016]. Disponible en: http://pediamecum.es/metotrexato/
- Mellado Peña MJ, Moreno-Pérez D, Ruíz Contreras J, Hernández-Sampelayo Matos T, Navarro Gómez ML. Documento de consenso de la Sociedad Española de Infectología Pediátrica y el Comité Asesor de Vacunas de la Asociación Española de Pediatría para la vacunación en inmunodeprimidos. Asociación Española de Pediatría; 2011. An Pediatr (Barc). 2011;75:413.e1-e22.
- Vacunación en niiños con enfermedades reumáticas (información para pediatras de Atención Primaria). En: Reumaped [en línea] [consultado el 28/06/2016]. Disponible en: http://goo.gl/B6tAIe