Probióticos y prebióticos en edad pediátrica: de la evidencia a la práctica clínica
PUNTOS CLAVE
- La microflora humana, conocida también como “microbiota” o “microbioma”, incluye bacterias, hongos, virus, bacteriófagos y algunas familias de levaduras.
- El microbioma humano (conjunto de genomas de los microorganismos que se hallan en el cuerpo humano) actúa de forma sinérgica con el anfitrión en una relación de simbiosis.
- La secuenciación metagenómica de la flora intestinal nos ha permitido identificar la existencia de tres enterotipos. Casi la totalidad de los estudios son previos a ella.
- La información de que disponemos sobre la composición microbiana del ecosistema digestivo, tanto en estado de salud como en diversas situaciones patológicas, es muy limitado.
- Los probióticos son microorganismos vivos que, cuando se administran en cantidades adecuadas, confiere un beneficio a la salud del consumidor.
- Los beneficios de los probióticos son cepadependientes y los beneficios de una cepa no se pueden extrapolar a otras.
- Los prebióticos son ingredientes alimentarios no digeribles que afectan beneficiosamente al huésped mediante la estimulación selectiva del crecimiento y/o de la actividad de un número limitado de bacterias.
- Los simbióticos son formulaciones que incluyen prebióticos y probióticos, aportando ambos beneficios para la salud del huésped.
- La colonización del tracto intestinal en la infancia depende de múltiples factores: colonización materna, tipo de parto, tipo de lactancia, país de residencia, empleo de antibióticos, etc.
- La administración de Lactobacillus disminuye la duración de la diarrea por virus. La utilización debe ser precoz y siempre acompañando a la rehidratación.
- Los probióticos son útiles para prevenir la diarrea asociada a antibióticos (DAA) pero no para tratarla.
- Hay evidencia sólida en cuanto a la eficacia y seguridad del uso de los probióticos en la enterocolitis necrotizante (ECN) de los recién nacidos pretérmino de entre 1000 y 1500 g, lo cual debe conducirnos a un cambio en la práctica clínica.
- Los prebióticos en la alimentación complementaria tienen escasas repercusiones beneficiosas, salvo el cambio en el número y consistencia de las heces, que se tornan más blandas.
- En los casos en que se considere el uso de probióticos para la prevención de la dermatitis atópica, el uso de los mismos será secuencial, es decir, empezándolo en la etapa pretérmino y por tanto en coordinación con el ginecólogo.
- No hay ninguna evidencia que soporte el uso de probióticos ni en el tratamiento ni en la prevención del asma, celiaquía o alergias alimentarias.
RESUMEN
Prescribir probióticos ha devenido una herramienta más en el arsenal terapéutico en el campo de la pediatría. Su utilización no está del todo incorporada a la práctica clínica diaria1. No obstante, existe suficiente evidencia en varias patologías. Los conocimientos sobre su utilidad no solo en la prevención sino también en el tratamiento de múltiples enfermedades (y no solo de la esfera gastrointestinal) requieren y requerirán un esfuerzo de formación continuada. Por eso, este artículo presenta una revisión actualizada según criterios basados en la evidencia que nos permitan reflexionar sobre la utilización que de ellos hacemos.
Los probióticos han demostrado ser efectivos en el tratamiento de la gastroenteritis aguda vírica en niños sanos, así como en la prevención, que no en el tratamiento, de la diarrea asociada a antibióticos. Su utilización en neonatos de entre 1000 y 1500 gramos previene la enterocolitis necrotizante, aunque no el riesgo de sepsis. La suplementación materna con Lactobacillus en el embarazo previene la dermatitis atópica, aunque no disponemos de suficiente evidencia en cuanto a su utilidad en el tratamiento de la misma. La adición de probióticos como terapia coadyuvante al tratamiento erradicador de Helicobacter pylori mejora la tasa de erradicación, disminuyendo los efectos secundarios al mismo. En la enfermedad inflamatoria intestinal, en el síndrome del intestino irritable y en el tratamiento del cólico del lactante, el grado de evidencia es mucho menor y son necesarios más estudios.
Los beneficios de los probióticos son cepadependientes, por lo que cada una de ellas debe ser estudiada individualmente ya que los beneficios en una no se pueden extrapolar a otras. Queremos remarcar que prácticamente la totalidad de los estudios actuales son previos a la secuenciación metagenómica de la flora intestinal, la incorporación de la cual podrá darnos más información sobre si los beneficios se dan o no ligados al tipo de enterotipo (de los tres que conocemos) que presenta el individuo.
INTRODUCCIÓN: MICROBIOTA INTESTINAL, UN ECOSISTEMA
Considerado por la revista Science como uno de los diez descubrimientos más importantes del 2011, el microbioma humano (conjunto de genomas de los microorganismos que se hallan en el cuerpo humano), que actúa de forma sinérgica con el anfitrión, con el que crea un ecosistema, ha ido adquiriendo, a nivel funcional, la categoría de “órgano”. La microflora humana, conocida también como “microbiota” o “microbioma” incluye bacterias, hongos, virus, bacteriófagos y algunas familias de levaduras. Desde nuestro nacimiento se establece la población microbiana en nuestro organismo, siendo capaz de colonizar la piel, el sistema genitourinario, el sistema respiratorio y, sobre todo, el intestino; esta colonización va a ser determinante para el desarrollo de nuestro sistema inmunitario. De la actividad de la flora localizada en el intestino, el individuo obtiene dos grandes beneficios: nutrición y defensa; el primero por la digestión y posterior absorción de nutrientes, y el segundo por el reconocimiento de elementos foráneos y el desarrollo de sistemas de prevención y rechazo de posibles agresiones desde el mundo exterior. En la última década hemos aprendido lo suficiente para poder afirmar que ambas dependen no solo de las estructuras del aparato digestivo sino también de la presencia y actividad de las comunidades microbianas que colonizan el tubo digestivo y fundamentalmente el intestino. Ambos elementos (tubo digestivo y microflora) son interdependientes y el equilibrio entre ambos condiciona la homeostasis del individuo dentro de su entorno ambiental. El intestino es el hábitat natural de una población muy numerosa, diversa y dinámica de microorganismos, principalmente bacterias, que se han adaptado a la vida en las superficies mucosas o en la luz del intestino. El ecosistema que lo habita está formado por lo que denominamos especies nativas (colonizan permanentemente el tracto gastrointestinal) y una serie variable de organismos vivos que transitan temporalmente por el tubo digestivo. Mientras que las bacterias nativas se adquieren al nacer y durante el primer año de vida, las bacterias en tránsito se ingieren continuamente a través de los alimentos, bebidas, contactos bucoorales etc. Al nacer, el intestino humano es estéril, y la primera colonización ocurre durante el parto y la primera alimentación. Posteriormente, aparecen cambios en la microbiota por influencia de los factores ambientales, edad, sexo, maduración inmune, etc., volviéndose relativamente estable tras el segundo año de vida.
Mientras que el estómago y el duodeno albergan un reducido número de microorganismos (menos de diez3 bacterias por g de contenido) que se adhieren a la superficie mucosa o bien están en tránsito, la población microbiana del intestino humano incluye unos 100 billones de bacterias pertenecientes a entre 500 y 1000 especies distintas. Los géneros predominantes se identificaron como Bacteroides, Bifidobacterium, Eubacterium, Clostridium, Lactobacillus, Fusobacterioum y diversos cocos grampositivos anaeróbicos. La relación del humano con su flora es de simbiosis, es decir de mutuo beneficio, pues mientras nosotros proporcionamos a la flora un hábitat y nutrición, las funciones de ésta contribuyen de manera significativa a nuestra fisiología. Fundamentalmente son tres las funciones primarias de la flora: a) función de nutrición y metabolismo como resultado de la actividad bioquímica de la flora, que incluye recuperación de energía en forma de ácidos grasos de cadena corta (puesto que el anfitrión los puede absorber), producción de vitaminas y efectos favorables sobre la absorción de calcio, y de hierro en el colón; b) función de protección, previniendo la invasión de agentes infecciosos o el sobrecrecimiento de especies residentes con potencial patógeno, y c) funciones tróficas sobre la proliferación y diferenciación del epitelio intestinal y sobre el desarrollo y modulación del sistema inmune. La secuenciación metagenómica de la flora intestinal nos ha permitido identificar la existencia de tres enterotipos, predominando en cada uno de ellos un tipo de bacteria distinta. El enterotipo A estaría dominado en un 20-30% por los Bacteroides. En el enterotipo Bifidobacterium dominaría la Prevotella, en un 10-12%. En el C predomina el Rominococcus. La dominancia de un enterotipo en un individuo condicionaría el equilibrio intestinal respecto al resto de bacterias que habitan en el intestino, de ahí que sea fácil pensar que una misma patología pueda requerir tratamientos diferentes y presente resultados distintos, según el tipo al que pertenezca el paciente.
A pesar de ello, la información de que disponemos sobre la composición microbiana del ecosistema digestivo, tanto en estado de salud como en diversas situaciones patológicas, es muy limitado. El intestino humano es una de las partes de nuestro cuerpo que más sorpresas nos está deparando, a medida que empezamos a entenderlo; es un órgano realmente fascinante, que funciona como un ente dinámico del que aún sabemos muy poco. Es más que probable que los contenidos que hoy exponemos queden obsoletos en el próximo bienio, por lo que este tema requerirá un especial esfuerzo de formación continuada por parte de todos.
¿Qué son los probióticos?
Si nos atenemos a las normas de la Organización Mundial de la Salud (OMS) sobre evaluación de los microorganismos destinados a ser usados como tales, un probiótico sería un microorganismo vivo que, cuando se administra en cantidades adecuadas, confiere un beneficio a la salud del consumidor. Queda claro, pues, que hablamos de un organismo externo al individuo que, en general, requiere de cantidades muy elevadas, del orden de 100 a 1000 millones de células por dosis, para ejercer un efecto notable. Esta definición concuerda con la recogida en el informe Guidelines for the evaluation of probiotics in food de la Organización de Naciones Unidas para la Agricultura (FAO) y la OMS, que reza: “Los probióticos son organismos vivos que cuando se administran en las cantidades adecuadas tienen efectos saludables en el huésped” (FAO WHO, 2002).
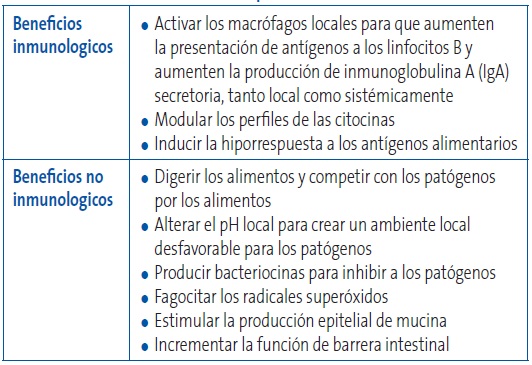
Un organismo destinado a ser usado como probiótico debe cumplir, en mayor o menor medida, algunos requisitos que podríamos denominar como “propiedades deseables”, que se recogen en la Tabla 1. Los mecanismos de acción de los probióticos se recogen en la Tabla 2. En el mercado podemos encontrar una gama muy amplia de diferentes tipos de productos que los contienen, desde los alimentos funcionales hasta los suplementos dietéticos y/o los nutracéuticos.
Tabla 1. Propiedades “deseables” de los probióticos. Mostrar/ocultar
Tabla 2. Mecanismos de acción de los probióticos. Mostrar/ocultar
¿Qué son los prebióticos?
Denominamos prebióticos (Tabla 3) a algunas sustancias de la dieta que nutren grupos seleccionados de microorganismos que habitan nuestro intestino, favoreciendo el crecimiento de bacterias beneficiosas por encima de las nocivas. Estas sustancias son diversas, aunque fundamentalmente se trata de polisacáridos no almidonados (PNA) y de algunos oligosacáridos (OS) no digeribles por enzimas humanas. Para que un prebiótico sea efectivo debe ser indigerible, o sea, no ser hidrolizado ni absorbido en la parte superior del aparato digestivo, ser específicamente fermentado estimulando el crecimiento y/o la actividad de las bifidobacterias y mejorar el estado de salud del huésped. Los prebióticos utilizados en nutrición son, básicamente: inulina, galactooligosacáridos (GOS) y fructooligosacáridos (FOS). Para el lactante el suministro natural de oligosacáridos es la leche materna y posteriormente la fuente dietética natural de FOS, como algunos vegetales entre los que destacan las cebollas, los espárragos, los ajos, las alcachofas, etc. En algunas publicaciones se considera también prebióticos los componentes de la fibra soluble (pectinas, gomas y mucílagos), cuyas fuentes dietéticas son fundamentalmente avena, legumbres, cítricos, y manzana. En realidad, estos serían más bien “alimentos colónicos” porque si bien llegan al colon sin ser modificados, no todos ellos consiguen estimular específicamente las bacterias beneficiosas.
Tabla 3. Definición de conceptos. Mostrar/ocultar
La leche materna humana, fuente de prebióticos
La leche humana (LH) contiene gran cantidad de oligosacáridos complejos (10-12 g/l) que son sustrato de las bifidobacterias y actúan como prebióticos naturales favoreciendo el desarrollo de una flora bifidógena. En las fórmulas infantiles se han añadido en los últimos años oligosacáridos con efecto prebiótico, fundamentalmente GOS y FOS, habitualmente a dosis de 0,8 g/100 ml y con una combinación de GOS (90%) y FOS (10%).
Los OS de la leche humana son hidratos de carbono que contienen lactosa en el extremo reductor y ácido siálico o fucosa en el otro extremo (no reductor). La mayoría de los OS de la LH tienen de tres a ocho moléculas de los siguientes monosacáridos: D-glucosa, D-galactosa, N-acetilglucosamina, L-fucosa y ácido siálico. A partir de la lactosa (extremo reductor) se añaden residuos de galactosa con un enlace β1-6 o residuos de N-acetilglucosamina unidos en un enlace 1-3 por medio de β-glicosil transferasas. De esta manera las moléculas se van haciendo más complejas a medida que se añaden residuos de fucosa o de lactosamina en distintas posiciones. Los OS de la LH pueden estar en forma libre o conjugada. Los OS son el tercer nutriente en importancia tras la lactosa y los lípidos. Dentro de los OS conjugados encontramos glicoproteínas, glicolípidos, glucosaminoglicanos y otros. Como bien sabemos la LH cambia constantemente de composición adaptándose a las necesidades del lactante. En relación a los OS libres, se observa que llega a niveles máximos en el calostro (entre 15 y 23 g/l), posteriormente descienden a niveles de entre 9 y 12 g/l en la leche madura y de entre 7 y 10 g/l en la leche al final del año de haberse iniciado la lactancia. Se han podido caracterizar 130 OS libres distintos, que cromatográficamente pueden clasificarse en GOS y FOS.
Los principales efectos demostrados de los OS de la LH son el antiinfeccioso y el bifidogénico2. Es debido precisamente a la presencia de esta flora bifidogénica que se producen las siguientes acciones:
- Inmunomoduladora: la flora microbiana con mayor cantidad de bifidobacterias favorecida por los oligosacáridos se asocia a una menor prevalencia de atopia.
- Metabólica: fermentación colónica con producción de ácidos grasos de cadena corta (AGCC), como los ácidos propiónico, butírico y acético.
- Nutricional: las bifidobacterias favorecen la síntesis de algunas vitaminas como la vitamina B6, la B12, el ácido fólico, el ácido nicotínico, etc., y favorecen a través de la fermentación colónica la absorción de calcio, magnesio, hierro y zinc.
¿Qué son los simbióticos?
Simbiótico proviene de la combinación de la palabra “sinergia” con el término griego βίος, que significa “vida” (S. Bengmarket al, 2005; J. Schrezenmeir, 2001). El tesauro de la Librería Nacional de Medicina (National Library of Medicine) de Estados Unidos (MeSH) define este término como “suplementos nutricionales que combinan probióticos (bacterias) y prebióticos (azúcares)”. Así, los simbióticos resultan de combinaciones apropiadas de prebióticos y probióticos, de forma que se dan los efectos beneficiosos de ambos. Hemos llevado a cabo una búsqueda de estudios publicados en PubMed/Medline que relacionen el consumo de simbióticos con potenciales beneficios en la salud infantil. No se han hallado metaanálisis. Sí se han hallado 12 ensayos aleatorizados controlados, mediante la siguiente estrategia de búsqueda: “synbiotics”[Mesh] AND (“infant”[MeSH Terms] OR “child”[MeSH Terms] OR “adolescent”[MeSH Terms]) AND Randomized Controlled Trial[ptyp].
PROBIÓTICOS Y PREBIÓTICOS DE INTERÉS EN LA INFANCIA: DE LA EVIDENCIA A LA PRÁCTICA CLÍNICA
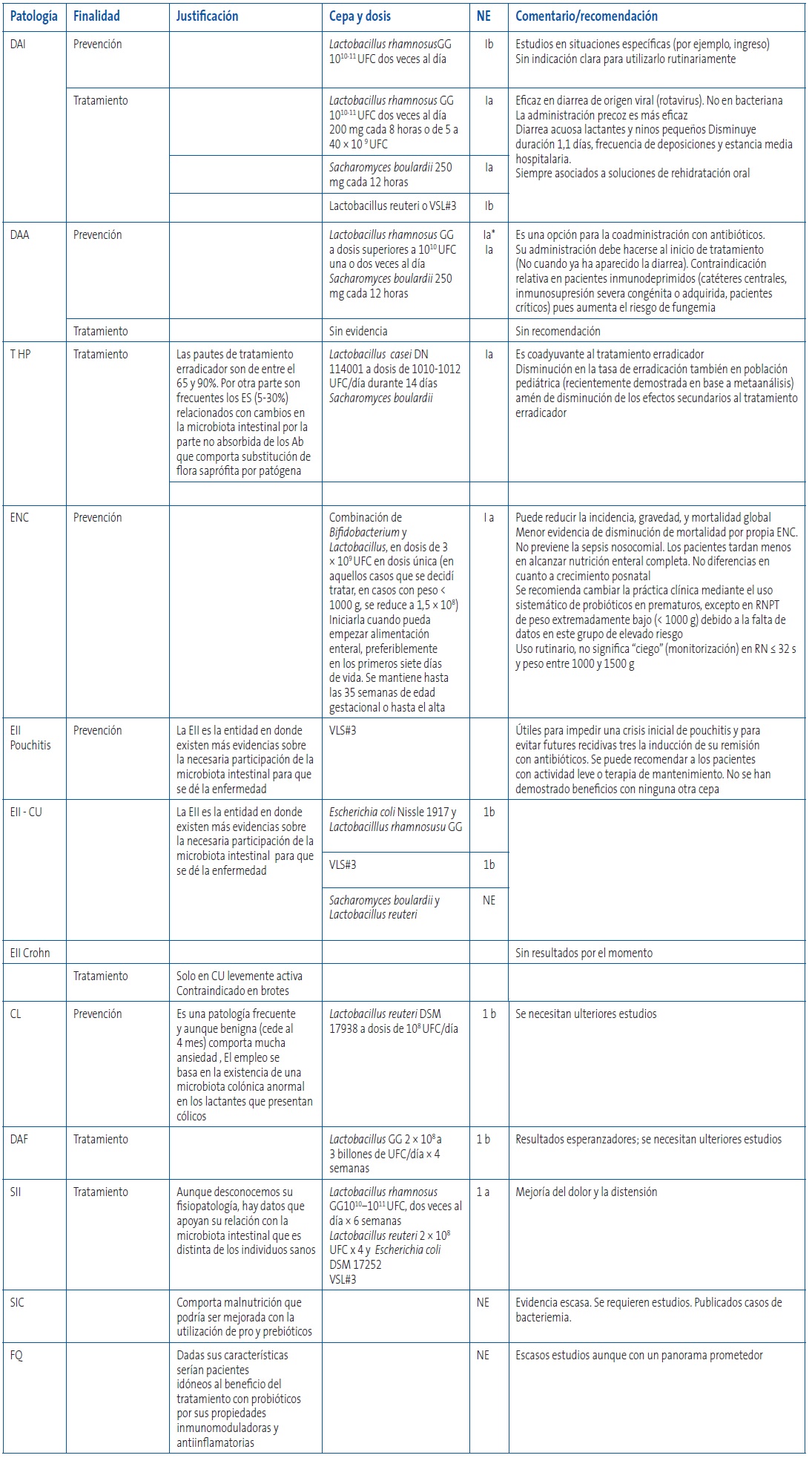
Se ha llevado a cabo una búsqueda en PubMed para localizar los ensayos aleatorizados controlados y los metaanálisis en niños de 0 a 18 años mediante la estrategia siguiente: Probiotics (MeSH) AND (Meta-Analysis(ptyp)) AND (“infant” (MeSH Terms) OR “child” (MeSH Terms) OR “adolescent” (MeSH Terms) OR “children” (MeSH Terms) OR “infant” (MeSH Terms). En la Tabla 4 se encuentran los trabajos referidos, detallando las conclusiones de cada uno de ellos. En esta revisión no se aborda la leche materna que, con grandes cantidades de prebióticos (oligosacáridos) es la alimentación preferible y de hecho el alimento único que deberían tomar los lactantes hasta los seis meses de edad. De hecho los niños lactados al pecho tienen una flora intestinal bifidogénica.
Tabla 4. Tabla resumen de las indicaciones basadas en la evidencia, referentes al uso de probióticos y prebióticos en patología digestiva en Pediatría. Mostrar/ocultar
Pese a ello y lo que vamos a desarrollar a continuación, debemos hacer constar que la Autoridad Europea deSeguridad Alimentaria (EFSA) (vinculada a la Comisión Europea y al Parlamento Europeo y cuyo consejo consultivo es representado en España por la Agencia Española de Seguridad –AESAN–), no ha autorizado, hasta la fecha, ninguna declaración en relación con los probióticos en alimentos funcionales (ha denegado 120 solicitudes hasta la fecha), salvo un papel del yogur en la digestión de la lactosa en personas que presentan una mala digestión a esta (EFSA, 2010; Flynn, 2012, EFSA 2013). Las declaraciones de salud que atribuyan mejoras a la ingesta de probióticos no autorizadas por la EFSA vulnerarían, por lo tanto, el artículo 5.1.a del Reglamento (CE) 1924/2006.
En cuanto a los prebióticos, es decir ingredientes presentes en los alimentos que no son digeribles y que pueden afectar beneficiosamente al huésped mediante la estimulación selectiva del crecimiento y/o de la actividad de una o de un número limitado de bacterias en el colon, hemos procedido a una estrategia de búsqueda semejante a la anterior encontrando dos metaanálisis y 63 EAC.
EFICACIA EN AFECTACIONES GASTROINTESTINALES
Diarrea infecciosa aguda
Tratamiento
Varios metaanálisis confirman que los probióticos disminuyen la duración y la severidad de la diarrea infecciosa aguda, sugiriendo que son seguros y eficaces. La evidencia es más sólida en relación a las gastroenteritis virales que en relación las debidas a infecciones bacterianas o parasitarias.
Estos datos llevaron al grupo de trabajo de probióticos y prebióticos de la Sociedad Europea de Gastroenterología y Hepatología y Nutrición Pediátrica (ESPGHAN)3,4 a publicar una revisión de la evidencia disponible, concluyendo que:
- Las cepas con mayor evidencia son Sacharomyces cerevisiae boulardii y Lactobacillus rhamnosus GG; y en menor medida Lactobacillus reuteri 17938.
- Se desaconseja específicamente el uso de la cepa Enterococcus faecium SF 68 por la posible resistencia a la vancomicina observada en estudios in vitro.
Queremos destacar que en el documento se valoró también la eficacia de Lactobacillus acidophilus LB, que, como comentaba el propio documento no entra dentro de la definición de probiótico, al tratarse de microorganismos no vivos (muertos térmicamente) y que otras guías no contemplan.
Prevención
En cuanto a la prevención de la diarrea aguda infantil, los resultados de los ensayos controlados aleatorizados (ECA) indican que existe beneficio, aunque modesto, en lactantes y preescolares sanos, fundamentalmente en las diarreas agudas producidas por rotavirus. Las cepas utilizadas han sido Lactobacillus rhamnosus GG, Lactobacillus caseiDN-114.001, Lactobacillus reuteri, B. lactis y Sacharomyces cerevisiae (boulardii), administradas como suplemento oral o mezcladas en la fórmula infantil; hay una mayor evidencia con la primera de ellas. Los estudios iniciales fueron realizados en centros de cuidado infantil, mientras que los tres incluidos en el metaanálisis de Szajewsla et al. (2011) se realizaron en niños hospitalizados (n= 1092). Resumiendo, con la evidencia actual no hay una clara recomendación de cara al uso rutinario de probióticos para la prevención de diarrea aguda de origen nosocomial; si en un caso específico se indicara, se realizaría con la cepa LGG.
Diarrea asociada a antibióticos
Tratamiento
No hay evidencia publicada sobre la utilidad de los probióticos en el manejo de la DAA, por lo que no podemos recomendar su uso.
Prevención
Contrariamente a lo anterior, hay un alto nivel de evidencia (nivel de evidencia Ia) en cuanto a que la administración de probióticos, en concreto de Lactobacillus rhamnosus GG o de Sacharomyces cerevisiae (boulardii), en niños que están recibiendo antibioterapia; son eficaces a la hora de prevenir la diarrea asociada a los antibióticos. Son once los metaanálisis que abordan este tema, el último de los cuales ha sido elaborado y publicado recientemente por la Cochrane1. Los resultados confirman que los probióticos son eficaces y seguros a la hora de prevenir la diarrea asociada a los antibióticos así como la diarrea asociada a infección por Clostridiumen edad pediátrica. Generalmente fueron bien tolerados, ocurrieron efectos secundarios menores con poca frecuencia y sin diferencias significativas entre los grupos de probióticos y de control. Los efectos secundarios informados incluyen erupción, náuseas, gases, flatulencias, vómitos, aumento de la flema, dolor torácico, estreñimiento, trastornos del gusto y poco apetito. Los datos actuales indican que el Lactobacillus rhamnosus y el Saccharomyces boulardii en una dosificación alta de 5 a 40 × 109 UFC/día pueden prevenir la apariciónde DAA, sin haberse documentado efectos secundarios graves en los niños sanos. No es posible establecer conclusiones acerca de la efectividad y la seguridad de otros agentes probióticos para la DAA en los niños. Los propios autores proponen que este beneficio de los probióticos en dosis altas debería confirmarse mediante un estudio aleatorio amplio y bien diseñado, y que sería también aconsejable disponer de estudios más refinados que evalúen los probióticos de otras cepas específicas y que informen tanto de la efectividad como de la seguridad de los mismos.
Cólico infantil
Tratamiento
El cólico infantil (CI) afecta hasta a un 20% de los lactantes de edad inferior a tres meses, causando importante nivel de estrés familiar, así como múltiples consultas. Existen excelentes revisiones que incluyen los múltiples enfoques terapéuticos, según nivel de evidencia5 , que para este cuadro se han propuesto. Dado que ninguno de ellos es realmente efectivo y que son los probióticos el tratamiento más utilizado en la práctica clínica diaria, en la actualidad son diversos los autores que se han revisado sistemáticamente la evidencia para evaluar su efectividad.
Sung et al.6 publicaron recientemente una revisión sistemática de estudios en lengua inglesa y metaanálisis (estudios desde junio de 1950 hasta junio de 2012) sobre los probióticos usados como prevención o tratamiento de los cólicos del lactante. Fueron seleccionados 12 estudios de los 1180 encontrados, con un total de 1825 niños. De los doce estudios, seis sugerían reducción en los cólicos, mientras que los seis restantes no la evidenciaban. Cuando se analizaron los tres estudios de lactantes alimentados con lactancia materna o mixta (mixta con predominio de la materna), se vio que en los lactantes el Lactobacillus reuterii reducía de forma marcada el llanto. Esta reducción aparecía a partir del séptimo día de administrarse el Lactobacillus reuterii,alcanzando el día 21 una reducción de 56,03 minutos en el llanto diario (IC 95: 59,92 a 52,15). No se registraron efectos adversos. A pesar de todo ello, la revisión concluía que, aunque podía ser efectivo, no había suficiente evidencia para generalizar su uso. Posteriormente, en junio de este mismo año, un grupo español hizo una revisión sistemática y un metaanálisis, ampliando el periodo de estudio cuatro meses más (hasta finales septiembre del 2012). Se seleccionaron ensayos de diseño aleatorios o casi aleatorios que comparaban la administración de probióticos (cualquier dosis o combinación) con placebo, control u otros métodos de tratamiento en lactantes sanos menores de cuatro meses nacidos a término, con CI, esta vez sin restricción idiomática a la lengua inglesa como hizo Sung en la anterior. De los 157 estudios seleccionados, 154 no cumplieron los criterios de inclusión por lo que finalmente solo tres fueron incluidos en el metaanálisis. Las conclusiones fueron totalmente superponibles a las anteriormente citadas, remarcando las autoras que sería necesario tratar con Lactobacillus reuterii a dos niños con CI durante 21 días para conseguir que uno respondiera a la intervención; una historia concomitante de atopia no alteraba la eficacia de los probióticos en los lactantes tratados7.
En 2014, el mismo grupo que había hecho la primera de las revisiones (Sung et al.) publica en el British Medical Journal los resultados de un nuevo estudio con 167 sujetos (en población australiana), aleatorizado, doble ciego, con placebo en lactantes (alimentados o no a pecho) afectos de CL8. Los resultados no solo no encontraron eficacia en los probióticos (a pesar de haber utilizado la misma cepa y en igual dosificación que en los 3 estudios referidos previamente,es decir Lactobacillus reuteri 1 × 108 UFC), sino que constataron que en el grupo que los había recibido se producía un aumento de las crisis de dolor o llanto. Ahora bien, esto solo sucedía en el grupo de niños alimentados con lactancia artificial, mientras que las diferencias no eran significativas en los niños alimentados a pecho. En el estudio no se encontraron diferencias en la biodiversidad fecal, niveles de E. coli patógena en las heces o en los niveles de calprotectina.
Los propios autores se plantean si el hecho de que los estudios se hayan hecho en poblaciones distintas (Australia frente a poblaciones europeas en los otros estudios) podría explicar parte de los resultados. Si estos se añaden al metaanálisis previo sigue persistiendo un resultado favorable a los probióticos.
Dados los resultados negativos, los mismos autores recomiendan cautela en la utilización de Lactobacillus reuterii DSM 17938, al mismo tiempo que plantean la necesidad de estar atentos a próximos resultados. De hecho, en este momento hay cinco estudios aleatorizados en marcha en diferentes partes del mundo9 y la Cochrane10 ha puesto en marcha un grupo de análisis para un próxima recomendación según un nuevo análisis de evidencias, que creemos muy necesario, mucho más si nos atenemos a que en algunos artículos se había empezado a plantear que esta medida formara parte de protocolos de asistencia11.
Prevención
No hay ningún estudio de calidad que evalúe el uso de probióticos en la prevención del CI.
Helicobacter pilorii
A día de hoy la evidencia de la efectividad de los probióticos en adultos es abrumadora: disponemos de ocho metaanálisis, uno de ellos en población exclusivamente infantil13 y otros dos que han analizado conjuntamente la población infantil y la adulta, haciendo posteriormente análisis de subgrupos12,14. Las conclusiones son claras (nivel de evidenciaI a): la suplementación con cepas específicas de probióticos como coadyuvante al tratamiento erradicador de la Helicobacter pilori (HP) debe ser considerada una opción para incrementar la tasa de erradicación, con mayor motivo cuando las terapias antibióticas son inefectivas. Se encuentra una disminución de efectos secundarios de los fármacos, sobre todo diarrea, que sigue sin estar plenamente confirmada en adultos. En ambos grupos son necesarios estudios para dilucidar este último aspecto así como la relación que puedan tener con las distintas cepas y dosis suministradas.
El metaanálisis de Sachdeva y Nagpal14 concluyó que los productos fermentados preparados a base de probióticos mejoran las tasas de eliminación de HP en aproximadamente entre un 5 y un 15%, aunquelos estudios que evalúan el papel de los probióticos sobre los efectos adversos de la infección con HP son heterogéneos.
Nuestros conocimientos actuales en cuanto a las cepas y formato de presentación de los probióticos según evidencia los podríamos resumir en los siguientes datos:
- Ha demostrado beneficios la Lactobacillus casei DN 114.001, a dosis de 1010-1012 UFC durante 14 días.
- Los resultados no son concluyentes en Lactobacillus acidophilus14 , ni en la combinación de Lactobacillus acidophilus con Bifidobacterium lactis.
- La administración de cepas Lactobacillus GG no ha mostrado eficacia15 en cuanto a erradicación de la diarrea, a pesar de algunos estudios iniciales prometedores, y sí, en cambio, en cuanto a la disminución de la diarrea que suele asociarse al tratamiento erradicador.
- La adición de Saccharomycesboulardii, que ha demostrado mejora de la incidencia de DAA, no mejora tampoco la tasa de erradicación de HP.
- Las presentaciones de probióticos en forma de leches fermentadas tienen mayor mejora en la tasa de erradicación, de entre un 5 y 15%14,16 , que las presentaciones en cápsulas o sobres (nutracéuticos). Probablemente ello sea debido a la presencia de otros componentes en las leches fermentadas como serían la lactoferrina o los glicomacropéptidos, con propiedades demostradas de inhibir el crecimiento de HP.
Enterocolitis necrotizante en recién nacidos pretérmino
La evidencia de la utilidad de los probióticos en la ECN de los pretérminos es muy sólida17 ,18. Ya en 2008, poco menos de un año después de que apareciera publicado el primer metaanálisis17 (Desphpande), una revisión de la Cochrane18 evidenció una disminución del riesgo de presentar nivel de evidencia C severa y de las tasas de mortalidad en prematuros de 1000 g en el momento de nacer. La evidencia era de tal solidez que planteaba un cambio en la práctica clínica, al tiempo que consideraba que se requerían ulteriores estudios en pretérminos de peso inferior al citado. La necesidad de ulteriores estudios en este subgrupo se planteaba porque (si bien la eficacia de los probióticos para la prevención de la ECN y/o de la mortalidad, es también válida para los neonatos con peso al nacer extremadamente bajo) no se podía garantizar, sobre la base del número de neonatos reclutados, que fuera segura en este grupo de alta vulnerabilidad; sobre todo teniendo en cuenta los casos (pocos) informados en la literatura sobre sepsis por especies de probióticos. En la actualización que hizo Cochrane de esta revisión tres años después se incluyeron 16 ensayos aleatorios y más de 2700 neonatos prematuros. Incluyó cinco ensayos controlados aleatorios adicionales en comparación con el metaanálisis que Deshpande et al. hicieron un año antes (2010). Los resultados fueron totalmente coherentes con los anteriores, permitiendo obtener una mayor robustez acerca de que la administración de probióticos reduce la incidencia de ECN grave, de mortalidad general y de mortalidad relacionada con la ECN; también se reducía el tiempo necesario para alcanzar una alimentación completa. Aunque parecía haber una tendencia en la reducción de la sepsis, estos datos no alcanzaron significación estadística. Sobre la base de las pruebas disponibles acerca del uso de probióticos en recién nacidos prematuros, el número de neonatos incluidos y el intervalo de confianza estrecho, concluyeron “de nuevo” que estaba justificado introducir modificaciones en la práctica clínica diaria. En paralelo se seguían demandando estudios adicionales que aportaran datos precisos sobre la eficacia en los neonatos de peso al nacer extremadamente bajo y sobre la preparación, la dosis y la duración óptimas del tratamiento. Por ello la literatura médica del último año ha sostenido un extenso debate acerca de si este es el momento de cambiar la práctica y adoptar los probióticos como el tratamiento estándar en ese grupo de neonatos prematuros. Si bien hay quienes proponen un cambio en la práctica sobre la base de una reducción significativa en la ECN grave y en la mortalidad por todas las causas, otros sugieren esperar hasta que haya más pruebas precisas sobre la eficacia y la seguridad en neonatos de peso al nacer extremadamente bajo y se haya establecido cuáles son la preparación y la dosis más efectivas en este contexto.
Resumiendo, la revisión actualizada de las pruebas disponibles apoyaun cambio en la práctica. Para evaluar la eficacia en neonatos con peso al nacer extremadamente bajo y para evaluar cuáles son la formulación y la dosis más efectivas se necesitan más estudios.
Intolerancia a la lactosa
La intolerancia a la lactosa es una causa común de dolor abdominal en niños mayores y adolescentes. Existen tres formas de intolerancia a la lactosa en función de su origen: deficiencia congénita de la lactasa, deficiencia primaria de la lactasa y deficiencia secundaria de la lactasa. El diagnóstico es esencialmente clínico, siendo recomendable la confirmación del diagnóstico a través de la realización de la prueba de aire espirado. El tratamiento consiste en disminuir o suprimir el aporte de lactosa, teniendo la precaución de asegurar un adecuado aporte de calcio.
La lactosa es un disacárido (compuesto por dos monosacáridos, glucosa y galactosa) presente exclusivamente en la leche de los mamíferos. La absorción de la lactosa, una vez hidrolizada por la lactasa, se lleva a cabo a nivel del intestino delgado (principalment en el yeyuno y en el íleon proximal). Esta Ð-galactosidasa se ubica en el borde en cepillo de los enterocitos apicales de las microvellosidades. En los animales esta enzima tiene una expresión variable a lo largo de su vida; es mínima antes de nacer, aumenta a su máxima expresión en el momento del parto y su actividad disminuye a un 10% tras el destete. Debido a los cambios evolutivos del ser humano y su mantención de ingesta de productos lácteos, la actividad de la lactasa, que se inicia a partir de las 34 semanas de gestación, se prolonga en algunos casos a lo largo de toda la vida, aunque con variaciones geográficas importantes.
La intolerancia a la lactosa es la respuesta sintomática al consumo de lactosa cuando no somos capaces de hidrolizarla por ausencia, total o parcial, de lactasa. Al no existir esta disacaridasa, la lactosa se acumula en la luz del intestino distal donde las bacterias generan ácidos orgánicos y gas hidrogeno. Estos son la causa de la flatulencia, meteorismo y dolor abdominal que presentan los pacientes; la presencia de ácidos grasos por otra parte, explica la acidificación de las deposiciones, que resulta en valores incluso inferiores a 5,5 que se traduce en un olor especialmente ácido y fácilmente reconocible. Por otra parte la lactosa es una sustancia osmóticamente activa que ocasiona la secreción de líquidos y de electrolitos a la luz intestinal hasta que se alcanza el equilibrio osmótico, siendo a veces este mecanismo suficiente por sí mismo para ocasionar diarrea. Los probióticos pueden mejorar la sintomatología, bien porque han sido añadidos previamente al alimento dando lugar a alimentos bajos en lactosa (por ejemplo la leche baja en lactosa) o bien prescritos directamente al paciente en forma de suplementos con la intención de modular la microbiota intestinal. El consumo de leches fermentadas mejora la tolerancia al degradarse la lactosa por las enzimas bacterianas, mejorando su digestibilidad y disminuyendo el vaciamiento gástrico. Algunas cepas como el Lactobacillus acidophilus y el Lactobacillus bulgaricus contienen β-galactosidasa y lactasa, con lo que podrían aumentar la digestión de la lactosa. También se ha demostrado en ratas la estimulación que el Saccharomyces boulardii realiza sobre las enzimas del ribete en cepillo de los enterocitos, como la lactasa.
Disponemos de múltiples estudios aleatorizados controlados (EAC) en población de edad adulta, aunque muy heterogéneos en cuanto a cepas, dosis y duración. Un metanaálisis que analizó diez de ellos19 concluyó que, si bien mejoraba la sintomatología, no podía concluirse que se redujera la tasa de intolerancia a la lactosa. En edad pediátrica hay ensayos clínicos de buena calidad metodológica aunque insuficiente tamaño muestral.
Enfermedad inflamatoria intestinal (EII)
Existe la hipótesis de que defectos en la barrera de la mucosa intestinal podrían iniciar respuestas anormales inmunes en las enfermedades inflamatorias intestinales.
Pouchitis
Hay buena evidencia(Ib), como recomendaban las guías mundiales de la World Gastroenterology Organisation (WGO)de 2011, sobre la utilidad de los probióticos para impedir una crisis inicial de pouchitiscon la mezcla de probióticos VSL#3 y evitar las recidivas futuras de esta entidad después de la inducción de su remisión con antibióticos. También hay evidencia de que la cepa de Escherichia coliNissle 1917 (EcN) y la Lactobacillus GG pueden ser útiles en el mantenimiento de la remisión20. Se pueden recomendar probióticos a pacientes con pouchitis de actividad leve o como terapia de mantenimiento para aquellos que estén en remisión.
Colitis ulcerosa
Losestudios de que disponemos, aunque de buena calidad, incluyen aún pocos pacientes. En concreto existe evidencia de la utilidad de VSL#3, que consiste en la concentración de 450 106 de bacterias acidas lácticas que comprenden ocho cepas diferentes (Bifidobacterium breve, Bifidobacterium longoum, Bifidobacterium infantis, Lactobacillus acidophilus, Lactobacillus plantarum, Lactobacillus casei, Lactobacillus bulgaris y Streptococcus thermophilus) en la inducción a la remisión y mantenimiento de la remisión de la colitis ulcerosa (CU) en pacientes pediátricos21. La cepa de Escherichia coliNissle 1917 (EcN) y la LactobacillusGG también han mostrado utilidad en el mantenimiento de la remisión de pacientes pediátricos con CU22.
Enfermedad de Crohn
Los estudios de probióticos en enfermedad de Crohn (EC) han sido decepcionantes y la revisión de Cochrane concluyó que no existe evidencia que sugiera que los probióticos son útiles en la EC; ni parala inducción a la remisión ni para el mantenimiento de la misma, y ello sucede tanto en población pediátrica como en la de edad adulta.
Síndrome del intestino irritable o dolor abdominal funcional
Dos cepas han demostrado su utilidad en la mejora del dolor abdominal funcional (criterios de Roma) en pacientes pediátricos: la Lactobacillus rhamnosus GG con un nivel de evidencia Ia (metaanálisis) y el Lactobacillus reuteri DSM 17938 con un nivel de evidencia Ib. En un metaanálisis de ensayos clínicos aleatorizados y controlados(ECAC), se demostró mejoría de los síntomas asociados, fundamentalmente de la sensación de distensión abdominal y dolor, administrando dosis de 1010 − 1011 UFC de Lactobacillus rhamnosus GG administradas dos veces al día durante 4-8 semanas. La Lactobacillus reuteri ha demostrado su utilidad en el manejo del dolor abdominal funcional en pacientes pediátricos. Estos recibieron una dosis de Lactobacillus reuterii de 2 × 108 UFC/día durante cuatro semanas, presentando una mejoría en la frecuencia e intensidad del dolor, de acuerdo a la escala visual de dolor de Wong-Baker, con respecto al grupo placebo a las ocho semanas de manejo.
Síndrome del intestino corto
La evidencia sobre el uso de probióticos y si estos podrían mejorar el estado nutricional de los niños afectos de síndrome del intestino corto SIC es muy escasa23 , sin que se puedan establecer resultados basados en la evidencia. Por otra parte, no podemos olvidar que ha habido algunos casos de bacteriemia secundaria a su administración. Además en los casos de SIC que cursan con acidosis D-láctica (raros), la utilización de probióticos podría empeorarla. En esta situación deberíamos restringir el aporte de azúcares de absorción rápida y de lácticos fermentados, a menos que contengan solo Lactobacillus casei y/o Bifidobacterium breve, puesto que estas cepas son productoras de L-lactato pero no de D-lactato.
Fibrosis quística
La fibrosis quística puede cursarcon inflamación de la mucosa intestinal y síndrome de hipercrecimiento bacteriano. Por ello ha sido fácil argumentar que los probióticos, al actuar como inmunomoduladores, antinflamatorios y reguladores de la microbiota, podrían ayudar a mejorar la función intestinal. En distintos estudios de buena calidad metodológica se ha observado que el tratamiento con probióticos puede no solo mejorar los parámetros digestivos y respiratorios: se observa una mejoría en los resultados de las pruebas funcionales respiratorias, acompañada de una menor tasa de exacerbaciones y de reingresos. No disponemos por el momento actual de ningún metaanálisis.
Los estudios muestran que, desde un punto de vista digestivo, el tratamiento con probióticos mejora la función intestinal tanto clínica como bioquímicamente. Por otra parte, el tratamiento con probióticos puede ser una alternativa al tratamiento descontaminante con antibióticos, por lo que su administración podría pautarse de forma regular. Aunque los estudios realizados muestran resultados interesantes y esperanzadores, estos deberían de tomarse como preliminares ya que la casuística de que disponemos aún es escasa.
BIBLIOGRAFÍA
- Johnston B, Goldenberg J, Vandvik P, Sun X, Guyatt G. Probióticos para la prevención de la diarrea asociada con antibióticos en niños (Revisión Cochrane traducida). En: Update-Software [en línea] [consultado el 17/12/2014]. Disponible en: http://www.update-software.com/PDF-ES/CD004827.pdf
- Vitoria I. Oligosacáridos en la leche humana. Acta Pediatr Esp. 2007;65:74-78.
- Guarino A, Ashkenazi S, Gendrel D, Lo Vecchio A, Shamir R, Szajewska H. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition/European Society for Pediatric Infectious Diseases evidence-based guidelines for the management of acute gastroenteritis in children in Europe: update 2014. J Pediatr Gastroenterol Nutr. 2014;59:132-52.
- Szajewska H, Guarino A, Hojsak I, Indrio F, Kolacek S, Shamir R, et al.Use of probiotics for management of acute gastroenteritis: a position paper by the ESPGHAN Working Group for Probiotics and Prebiotics. J Pediatr Gastroenterol Nutr. 2014;58:531-9.
- Dobson D, Lucassen PL, Miller JJ, Vlieger AM, Prescott P, Lewith G. Manipulative therapies for infantile colic. Cochrane Database Syst Rev. 2012;12:CD004796.
- Sung V, Collett S, De Gooyer T, Hiscock H, Tang M, Wake M. Probiotics to prevent or treat excesive infant crying: systematic review and meta-analysis. JAMA Pediatr 2013;167:1150-7.
- Llerena Santa Cruz E, Jullien S. ¿Qué impacto clínico tiene la utilización de probióticos en los cólicos del lactante? Rev Pediatr Aten Primaria. 2014;16:155-8.
- Sung V, Hiscock H, Tang ML, Mensah FK, Nation ML, Satzke C, et al. Treating infant Colic with the probiotic Lactobacillus reuteri: double blind, placebo controlled randomised trial. BMJ. 2014;348:g2107.
- MetaRegister Oof Controlled Trials. Registered trials numbers ISRCTN95287767, NCT01067027, NCT01279265, NCT01541046, NCT01017991 [en línea] [consultado el 17/12/2014]. Disponible en: www.controlled-trials.com/mrct/search.html
- Praveen V, Praveen S, Deshpande G, Patole SK. Oral probiotics for infantile colic. Cochrane Database of Systematic Reviews 2014, Issue 3. Art. No.: CD010986.
- Savino F, Ceratto S, De Marco A, Cordero di Montezemolo L. Looking for new treatments of infantile colic. Ital J Pediatr. 2014;40:53.
- Dang Y, Reinhardt JD, Zhou X, Zhang G. The effect of probiotics supplementation on helicobacter pylori eradication rates and side effects during eradication therapy: a meta-analysis. PLoS One. 2014;9:e111030.
- Li S, Huang XL, Sui JZ, Chen SY, Xie YT, Deng Y, et al. Meta-analysis of randomized controlled trials on the efficacy of probiotics in Helicobacter pylori eradication therapy in children. Eur J Pediatr. 2014 Feb;173(2):153-61.
- Sachdeva A, Naqpal J. Effect of fermented milk-based probiotic preparations on Helicobacter pylori eradication: a systematic review and meta-analysis of randomized-controlled trials. Eur J Gastroenterol Hepatol. 2009;21:45-53.
- Szajewska H, Albrecht P, Topczewska-Cabanek A. Randomized, double-blind, placebo-controlled trial: effect of lactobacillus GG supplementation on Helicobacter pylori eradication rates and side effects during treatment in children. J Pediatr Gastroenterol Nutr. 2009;48:431-6.
- Sachdeva A, Rawat S, Naqpal J. Efficacy of fermented milk and whey proteins in Helicobacter pylori eradication: a review. World J Gastroenterol. 2014;20:724-37.
- Deshpande G, Rao SC, Patole SK, Bulsara M. Updated meta-analysis of probiotics fro prevention necrotizing enterocolitis in preterm neonates. Pediatrics 2010;125:921-30.
- Alfaleh K, Anabrees J, Bassler D, Al-Kharfi T. Probiotics for prevention of necrotizing enterocolitis in preterm infants. Cochrane Database Syst Rev. 2011;(3):CD005496.
- Levri KM, et al. Do probiotics reduce adult lactose intolerance? A systematic review. J Fam Pract. 2005;54:613-20.
- Fedorak R, Demeria D. Probiotic bacteria in the prevention and treatment of inflamatory bowel disease. Gastroenterol Clin North Am. 2012;41:821-42.
- Miele E, Pascarella F, Giannetti E. Effect of a preparation (VSL#3) on induction and maintance of remission in children with ulcerative colitis. Am J Gastroenterol. 2009;104:437-443.
- Henker J, Muller S, Laass MW. Probiotic Escherchia coli Nissle 1917 (EcN) for successful remission maintenance of ulcerative colitis in children and adolescents: an openlabel pilot study. Z Gastroenterol 2008;46:874-5.
- Reddy VS, Patole SK, Rao Sh. Role of Probiotics in Short Bowel Syndrome in infants and Children-A systemic review. Nutrients. 2013;5:679-699.
Cómo citar este artículo
Artículos relacionados
 Probióticos y prebióticos en Pediatría (2.ª parte)
Probióticos y prebióticos en Pediatría (2.ª parte)
Panisello Royo JM. Probióticos y prebióticos en Pediatría (2.ª parte). Form Act Pediatr Aten Prim. 2015;8;26-37 Probióticos y cólico del lactante: puesta al día
Probióticos y cólico del lactante: puesta al día
Aparicio Rodrigo M. Probióticos y cólico del lactante: puesta al día. Form Act Pediatr Aten Prim. 2014;7;102-3 Los probióticos no parecen ser eficaces para tratar los síntomas del cólico del lactante
Los probióticos no parecen ser eficaces para tratar los síntomas del cólico del lactante
Buñuel Álvarez JC. Los probióticos no parecen ser eficaces para tratar los síntomas del cólico del lactante. Form Act Pediatr Aten Prim. 2011;4;116-7